
В процессе охлаждения (и длительного хранения) молока на фермах и заводах при температуре 3…5Х происходит в той или иной степени изменение почти всех основных составных частей молока и его свойств, Более значительному изменению подвергаются белки и жир, менее значительному — витамины, соли. Нарушение структуры белковых и липидных компонентов часто сопровождается ухудшением органолептических, физико-химических и технологических свойств молока. Вследствие перехода жира из жидкого состояния в твердое несколько повышается вязкость и плотность молока, титруемая кислотность увеличивается на 0,5…2Т и т. д.
Белки. Во время охлаждения (и хранения) молока при низких положительных температурах белковая система молока (в основном казеин) может претерпевать серьезные изменения. Ослабляются гидрофобные взаимодействия, что приводит к выходу из состава казеиновых мицелл 3-казеика и фосфата кальция, меняется структура мицелл. Растворимый р-казеин подвергается действию пативных и бактериальных протеаз, В результате повышается дисперсность казеина и меняются технологические свойства молока.
Известно, что длительное хранение молока при 4’С сопровождается возрастанием количества растворимого казеина, достигающего через 48 ч хранения 22,..42% всего казеина (рис. 5.1).
Растворимый казеин охлажденного молока представлен главным образом р-казеином, который легко диссоциирует с поверхности и из внутренней части мицелл при понижении температуры молока. Максимальное количество растворимого р-казеина через 48 ч хранения молока при 4°С может составлять 30… 60% всего Р-казеина.
|
|
Рис. 5.1. Изменение количества растворимого казеина в процессе хранения сырого молока при температуре (по Али и др.): 1 — 4’С;2— Ю’С;3— 15’С
Таким образом, в процессе охлаждения к длительного хранения молока при низких температурах происходит изменение структуры казеиновых мицелл с выходом из их состава части казеина, в первую очередь (i-казеина. fi-Казеин переходит в плазму молока в виде мономеров, которые чувствительны к действию нативных и бактериальных протеаз. В результате протсолиза |3-казеин распадается на у-казенны и фосфопептиды.
ГГротеолиз фракций казеина в молоке могут катализировать щелочные и кислые нативпые и бактериальные п роте азы. Протеолиз 3-ка — зеина, вероятно, вызывает в основном нативная щелочная протеаза.
В молоке содержится нативная протеаза, идентичная ферменту плазмы крови животных плазмину и относящаяся к классу щелочных (сериновых) протеаз. Щелочные протеазы имеют максимум активности при слабощелочном рН 7,5…8 и температуре 37"С, но проявляют достаточно высокую активность при рН 6,5.. 9 и низких температурах. Они и н гиб иру юте я типичными ингибиторами трипсина и гидролизуют пептидные связи, образованные Apr и Лиз. По-видимому плазмин (или era неакгивная форма плазмшюген) переходит в молоко из плазмы крови. Особенно много плазмина содержит молозиво и маститное молоко. Вместе с плазмином в молоко переходят активаторы и ингибиторы фермента.
Плазмин обладает специфичностью по отношению к фракциям казеина — предпочтительно атакует р — и а^-казеин (и возможно — к-казеин) и неактивен по отношению к а8|-казеину.
Действие фермента на (3-казеин проявляется в расщеплении пептидных связей Лиз(28)—Лиз(29), Лиз(105)-Гис(106) и Лиз(107) — Глу(108) в его полипептидной цепи (см. рис. 2.3 нас. 66). В результате протеолиза образуются 7,-, уу — и у.-казенны и фосфопептиды (фракции 5 и 8 протеозо — пептонов).
Образование у-казеинов в молоке при охлаждении и хранении при различных температурах, представлено на рис. 5.2. Более высокая скорость протеолиза р-казеина при низ-
|
Продолжительность жрменм, ч |
Рис. 5.2. Изменение количества-у-казеина в процессе хранения молока при равных темперачурах (по Раймердесу): 1—А’С\2— 1 ГС; J-26’С
Ких температурах по сравнению с Еротеолизом при высоких температурах обусловлена разной чувствительностью к действию фермен — та мономерной и мицеллярной форм (3-казеина.
Изменение структуры казеиновых мицелл в процессе охлаждения и хранения молока при низких температурах сопровождается изменением технологических свойств. В первую очередь увеличивается продолжительность сычужного свертывания молока и снижается качество образовавшихся сгустков — плотность, эластичность, интенсивность еинерезиса и т. д. Также снижается термоустойчивость молока, особенно резко после хранения в течение 72 ч.
Распад белков в сыром охлажденном молоке при длительном хра — нении могуг вызывать также протеолитические ферменты психро — трофных бактерий родов Pseudomonas, Achromobacter, AJcaligensn др. Известно, что бактериальные протеазы в большей степени атакуют к-казеин, чем Я — и а5-казеин, однако они могут способствовать образованию горьких пептидов и других нежелательных продуктов, придающих молоку посторонние привкусы.
Таким образом, охлаждение и длительное хранение сырого молока при низких температурах способствует образованию у-казеина и других продуктов распада казеина, которые могут отрицательно али — ять на технологические свойства (способность свертываться под действием сычужного фермента, структурно-механические и синерети — ческие свойства белковых сгустков, термоустойчивость и др.), на выход сыра и других белковых продуктов (у-казеин не свертывается сычужным ферментом и -«теряется» с сывороткой), а также на органо — лептические свойсгва молока и готовых продуктов.
В связи с этим следует избегать длительного хранения сырого молока перед переработкой в белковые продукты и молочные консервы, а если длительное хранение неизбежно, необходимо применять пастеризацию или термпзацию (более мягкую тепловую обработку при температуре 60.,.65"С с выдержкой от 2 до 20 с и выше) молока перед хранением.
Лкгшды. В процессе охлаждения и хранения охлажденного молока меняется агрегатное состояние триацилглицеринов молочного жира, в результате которого нарушается структура оболочек жировых шариков. Оболочка приобретает хрупкость и проницаемость для жидкого жира, то есть наступает дестабилизация жира с образованием свободного жира. Перемешивание молока увеличивает степень дестабилизации. Затем наступает гидролиз свободного жира под действием липолитических ферментов — липолиз. Распад молочного жира с освобождением жирных кислот сопровождается появлением пороков вкуса молока — прогорклого, салистого и других привкусов. Гидролиз жира может быть вызван в основном нативными липазами и в какой-то степени — липазами пеихротрофных микроорганизмов. При хранении молока в условиях низких температур бактериальные липазы играют по-види — мому, незначительную роль в липолизе. Гидролитическое прогор — кание может быть обусловлено деятельностью пеихротрофных бактерий лишь при содержании их в количестве свыше 106,.,107 клеток в 1 см1. Вместе с тем нативные липазы, вступая в контакт с жиром при определенных условиях, вызывают его гидролиз, При этом различают два вида липолиза: спонтанный (самопроизвольный) и индуцированный (наведенный).
Спонтанный липолиз происходит при охлаждении молока, склонного к прогорканию. В процессе охлаждения плазменная липаза, связываясь с оболочками шариков жира становится мембранной и вызывает гидролиз жира. Чувствительность молока к липолизу обусловливается зоотехническими факторами — индивидуальными особенностями животных, их физиологическим состоянием, стадией лактации, режимами кормления и др. Спонтанный липолиз особенно характерен для стародойного молока и молока, полученного от больных маститом животных,
Индуцированный липолиз возникает при разрушении оболочек шариков жира в процессе получения и обработки молока с одновременным активированием липазы. Прогорканию молока способствуют многочисленные факторы, К ним следует отнести нарушение техники машинного доения — неправильную установку молокопроводов, завышение их диаметра, особенно на стыках, подсос воздуха в системе и пр. Установлено, что частота возникновения липолиза молока при доении коров вручную в 1,5,,,2 раза ниже, чем при машинном доении. Сильное разрушение оболочек шариков жира и повышение активности липазы обусловлено интенсивным механическим воздействием на молоко при транспортировании, а также многократным перемешиванием и перекачиванием в процессе длительного хранения при низких температурах. Так, содержание свободных жирных кислот (СЖК) в молоке к концу первых суток хранения при 3…5*С увеличивается (поданным ВНИМИ) в среднем на 30%, к концу вторых суток — на 50%,
Прогоркание молока наступает при определенном содержании СЖК. Так, прогорклый вкус и посторонние запахи {кормовой, мыльный, рыбный) молоко приобретает при концентрации СЖК более 20мг% (данные В, Г. Атраментовой), Поданным М. С — Уманского, концентрация СЖК должна превышать 42 мг%, а по данным В. П. Шидловской — быть равной 25,6…34 ш%.
Степень влияния отдельных жирных кислот на вкус молока не выяснена. Одни исследователи считают, что прогорклый вкус молока обусловливает преимущественно масляная кислота, другие полагают, что каприновая и лауриновая. Возможно, все жирные кислоты от С4 до С]2 в равной степени влияют на вкус молока, так как имеют почти одинаковые пороги чувствительности в молоке.
Молочные продукты, и особенно масло, выработанное из молока, в котором протекают липолитические процессы, имеют пороки вкуса и запаха. Для их предупреждения необходимо соблюдать правила получения, транспортирования и хранения молока, а также контролировать степень липолиза перед его переработкой. Количество СЖК можно определить путем титрования молочного жира, выделенного из молока, раствором гидроксида калия. На практике пригодность молока для переработки на масло и другие молочные продукты контролируют в основном органолептическим путем.
В промессе охлаждения и хранения молока происходит частичный переход фосфолипидов из оболочек жировых шариков в плазму. Скорость перехода зависит от температуры охлаждения, продолжительности хранения и степени механического воздействия на молоко.
Соли, витамины и ферменты. При охлаждении, хранении и транспортировании молока наблюдается перераспределение форм минеральных веществ, некоторое снижение количества водорастворимых витаминов и повышение активности некоторых ферментов. Так, часть мицеллярного фосфата кальция приобретает растворимость и переходит в плазму (сыворотку). Снижения содержания витаминов при охлаждении и хранении молока почти не наблюдается. Исключение составляет аскорбиновая кислота и в меньшей степени — тиамин и рибофлавин. При хранении охлажденного молока в течение 2 сут аскорбиновая кислота разрушается на 18%, а в течение 3 сут — на 30..,70% (в зависимости от температуры хранения). Охлаждение и хранение молока может вызвать повышение активности плазмина, липазы и ксантиноксидазы.
molokoportal.ru
Чтобы ответить на этот вопрос, мы займемся научными экспериментами прямо на кухне. Ведь именно тут можно найти все необходимые материалы для сегодняшних опытов.
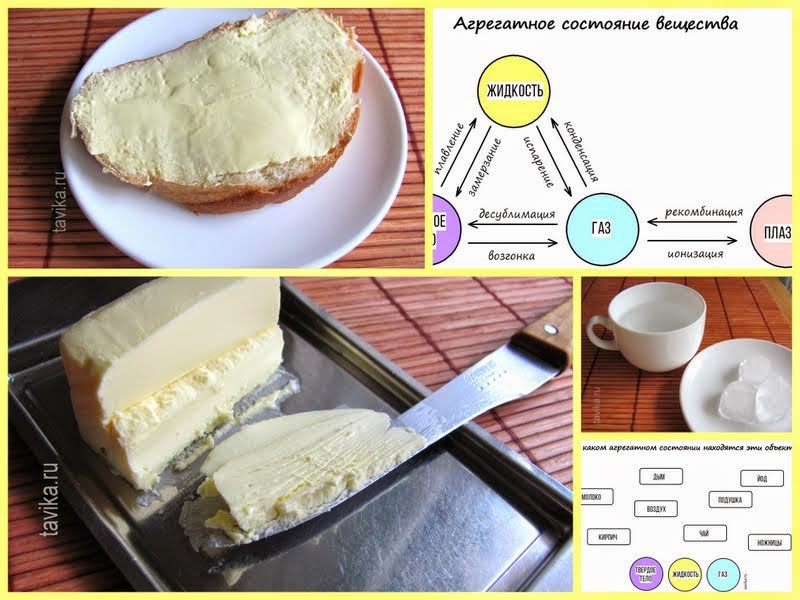 Действительно, если достать из холодильника твердый кусочек масла и положить его в горячую кашу, то скоро мы увидим, как он превратится в желтую водичку. Говорят "масло растаяло". А вот ученые-физики бы сказали: "Масло изменило свое агрегатное состояние". Что это значит?
Действительно, если достать из холодильника твердый кусочек масла и положить его в горячую кашу, то скоро мы увидим, как он превратится в желтую водичку. Говорят "масло растаяло". А вот ученые-физики бы сказали: "Масло изменило свое агрегатное состояние". Что это значит?| Масло в каше |
Давайте с ребенком изучим (а кто знает, повторим) различные состояния вещества. Ведь все на свете вещи и вещества находятся в каком-то одном из состояний (агрегатных состояний): твердом, жидком, газообразном или в виде плазмы.
Думаю, что различия в них ребенок лучше всего поймет на бытовом уровне. Твердое состояние - это все, что не течет: не только камень и металл, но и бумага, и вата (хоть она не твердая, а мягкая). Жидкое состояние - это то, что течет: вода, молоко и т.д. Газообразное - это все, что становится воздухом, дымом, паром. А плазма - это особое состояние вещества, которое возникает при очень сложных условиях, которые можно встретить в космосе или в лаборатории ученых. В этом состоянии вещество разлетается на те частички, из которых оно состоит - на отдельные атомы и молекулы. А мы с вами можем ее увидеть в плазменном шаре - такой светящейся лампе с "молниями".
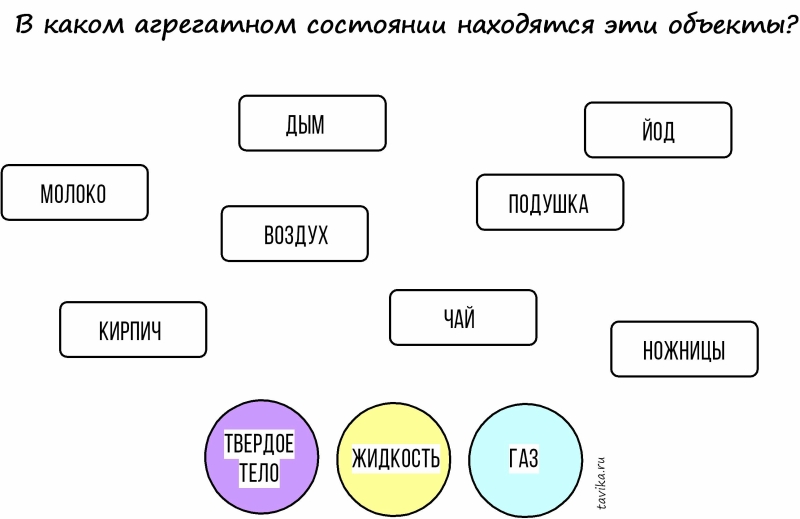
Задание: Определяем агрегатные состояния вещества.
Попросите ребенка соединить слова в прямоугольниках с нужным кружочком.(насчет подбора примеров см. в комментариях).
Любое вещество на свете может перейти из одного состояния в любое другое (кроме плазмы, которая получается при переходе из газообразного). Да-да, даже железный чайник может стать и жидким, или газообразным, или плазмой. Просто с чайником это невозможно увидеть на кухне: нужно создавать специальные условия для него. Легче всего превращения вещества из одного агрегатного состояния в другое проследить на примере воды - потому что для нее условия перехода совсем несложные. Она меняет свое состояние при незначительных перепадах температуры, которые мы ей можем организовать на кухне.
Опыт 1. Агрегатные состояния воды.
Поставьте перед малышом блюдце со льдом и чашку с горячей водой (такой, чтобы от нее шел пар). Попросите показать, в каком случае вода в жидком, твердом и газообразном состоянии. И проследите, что с водой будет происходить, как вода меняет свое агрегатное состояние. Задайте вопрос, как воду из одного состояния можно перевести в другое? Что для этого нужно? Проделайте с водой все названные превращения. Например, чтобы вода перешла из из твердого в жидкое состояние - ее надо нагреть. Тогда лед растает, а физики говорят - расплавится. Произойдет это не в любой момент, а лишь когда лед нагреется до температуры ноль градусов. И паром вода станет не при любой температуре, а только при 100 градусах (при нормальном давлении, конечно).
| В каких агрегатных состояниях находится вода на фото? |
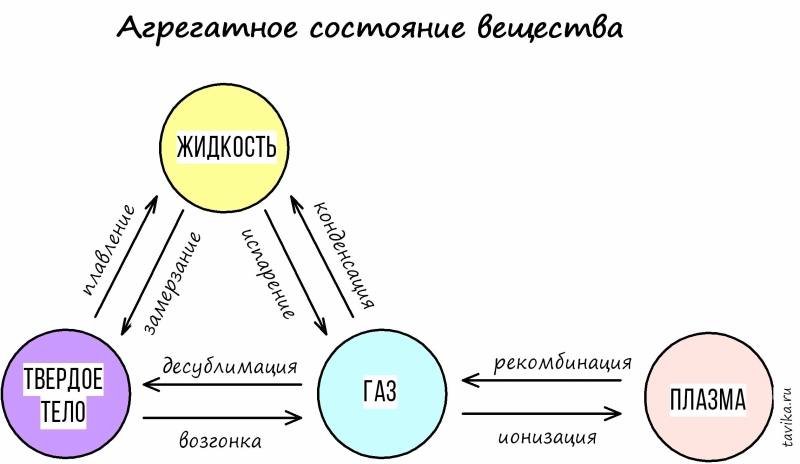
То, что мы наблюдали с водой, верно для любого вещества. Любое вещество может из твердого стать жидким (этот процесс называется плавление), а из жидкого - газообразным (это процесс называется испарение). Может и наоборот: из газообразного стать жидким (конденсация), а из жидкого - твердым (замерзание). И даже может из твердого сразу стать газообразным, минуя стадию жидкого (это называется возгонка) и обратно (называется десублимация).
Чтобы вы не запутались, я нарисовала схему превращения веществ:
Теперь у нас есть все нужные знания, чтобы понять, почему масло в каше тает.
Ведь что такое с физической точки зрения происходит, когда говорят "тает"? Правильно - переходит из твердого состояния в жидкое. То есть происходит процесс плавления. А как мы поняли, он происходит при определенной температуре (и давлении, но давление у нас на кухне самое обычное, поэтому мы его в расчет не берем). То есть, масло тает потому, что в горячей каше оно нагрелось до температуры своего плавления.
А какая у него температура плавления? Когда масло начнет таять? Так же как и вода, при нуле градусов, или только в горячей каше, при почти 60 градусах? Давайте проведем эксперимент.
Опыт 2. Температура плавления масла.
Масло у нас в холодильнике хранится при температуре около +5 градусов. Давайте достанем его и поставим на стол. А рядом положим термометр. И подождем минут 10. Термометр в комнате покажет около 20-25 градусов. Что при этой температуре произойдет с маслом? Оно станет мягким, но еще не жидким. А если поставить масло на солнечный подоконник. термометр покажет 30-40 градусов, а масло начнет течь. (Конкретная температура зависит от состава того масла, с которым проводятся опыты).
| Эксперимент с температурой плавления масла |
А напоследок, раз мы уже достали масло из холодильника, давайте проведем с вами еще один эксперимент. Шуточный :) Сколько раз вы и ваш ребенок слышали фразу "Бутерброд всегда падает маслом вниз"? Всегда ли? Давайте это проверим!
Опыт 3. Проверяем закон бутерброда.
Опыты - это хорошо, но и бутерброд валять по полу жалко. Поэтому мы постелили на пол пищевую пленку, чтобы после наших экспериментов бутерброды можно было спокойно съесть. И стали мазать бутерброды и ронять их разными способами - просто из рук и с края стола. В результате после серии из 10 экспериментов оказалось, что все 5 бутербродов, которые мы роняли, столкнув с края стола, падали маслом вниз. А все 5 бутербродов, которые мы роняли из рук, падали маслом вверх. Вывод: закон бутерброда действует не во всех случаях.
| Бутерброд готов к испытанию! |
А чтобы я ответила на ваши вопросы, вступайте в Клуб и задавайте их!
Для этого надо:
1) Поставить баннер на боковую панель вашего блога или сайта (код баннера можно взять, перейдя на страницу "Клуба почемучек"), а если блога нет, то дать ссылку на страницу Клуба в своих соц. сетях.2) Прислать ваш вопрос мне на почту tavika2000 @ yandex.ua (убрать пробелы) с пометкой "Клуб почемучек".
ВНИМАНИЕ! Среди всех присланных весной и летом вопросов в начале сентября я разыграю ПРИЗ. Независимо от того, сделала я ответ на вопрос или нет. Подробности о призе будут ближе к розыгрышу отдельным постом.
Подписаться на новости Клуба можно прямо тут, заполнив форму рассылки.
После этого вам на почту будут приходить ссылки на новые выпуски "Клуба почемучек" и сообщения о розыгрышах призов.
Архив прошлых выпусков "Клуба почемучек" можно посмотреть ЗДЕСЬ.www.tavika.ru
Вопросы о том, что такое агрегатное состояние, какими особенностями и свойствами обладают твердые вещества, жидкости и газы, рассматриваются в нескольких учебных курсах. Существует три классических состояния материи, со своими характерными чертами строения. Их понимание является важным моментом в постижении наук о Земле, живых организмах, производственной деятельности. Эти вопросы изучают физика, химия, география, геология, физическая химия и другие научные дисциплины. Вещества, находящиеся при определенных условиях в одном из трех базовых типов состояния, могут изменяться при повышении или понижении температуры, давления. Рассмотрим возможные переходы из одних агрегатных состояний в другие, как они осуществляются в природе, технике и повседневной жизни.
Слово латинского происхождения "aggrego" в переводе на русский язык означает «присоединять». Научный термин относится к состоянию одного и того же тела, вещества. Существование при определенных температурных значениях и разном давлении твердых тел, газов и жидкостей характерно для всех оболочек Земли. Помимо трех базовых агрегатных состояний, существует еще и четвертое. При повышенной температуре и неизменном давлении газ превращается в плазму. Чтобы лучше понять, что такое агрегатное состояние, необходимо вспомнить о мельчайших частицах, из которых состоят вещества и тела.
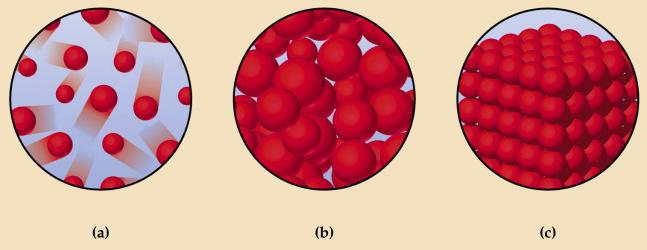
На схеме вверху показаны: а — газ; b — жидкость; с — твердое тело. На подобных рисунках кружочками обозначаются структурные элементы веществ. Это условное обозначение, на самом деле атомы, молекулы, ионы не являются сплошными шариками. Атомы состоят из положительно заряженного ядра, вокруг которого на большой скорости движутся отрицательно заряженные электроны. Знания о микроскопическом строении вещества помогают лучше понять различия, существующие между разными агрегатными формами.
Первые сведения о частицах, из которых сложены физические тела, появились в Древней Греции. Мыслители Демокрит и Эпикур ввели такое понятие, как атом. Они считали, что эти мельчайшие неделимые частицы разных веществ обладают формой, определенными размерами, способны к движению и взаимодействию друг с другом. Атомистика стала наиболее передовым для своего времени учением Древней Греции. Но ее развитие затормозилось в средние века. Так как тогда ученых преследовала инквизиция римской католической церкви. Поэтому вплоть до нового времени не было внятной концепции, что такое агрегатное состояние вещества. Только после XVII века ученые Р. Бойль, М. Ломоносов, Д. Дальтон, А. Лавуазье сформулировали положения атомно-молекулярной теории, не утратившие своего значения и в наши дни.
Значительный прорыв в понимании микромира произошел в XX веке, когда был изобретен электронный микроскоп. С учетом открытий, сделанных учеными ранее, удалось сложить стройную картину микромира. Теории, описывающие состояние и поведение мельчайших частиц вещества, довольно сложные, они относятся к области квантовой физики. Для понимания особенностей разных агрегатных состояний материи достаточно знать названия и особенности основных структурных частиц, которые образуют разные вещества.
Есть вещества, частицы которых определенным образом расположены в пространстве. Упорядоченное взаимное положение атомов, ионов, молекул называют кристаллической решеткой. Обычно ионные и атомарные кристаллические решетки характерны для твердых веществ, молекулярные - для жидкостей и газов. Высокой твердостью отличается алмаз. Его атомная кристаллическая решетка образована атомами углерода. Но мягкий графит тоже состоит из атомов этого химического элемента. Только они по-другому расположены в пространстве. Обычное агрегатное состояние серы — твердое, но при высоких температурах вещество превращается в жидкость и аморфную массу.

Твердые тела при обычных условиях сохраняют объем и форму. Например, песчинка, крупинка сахара, соли, кусок горной породы или металла. Если нагревать сахар, то вещество начинает плавиться, превращаясь в вязкую коричневую жидкость. Прекратим нагревание — снова получим твердое вещество. Значит, одно из главных условий перехода твердого тела в жидкость — его нагревание или повышение внутренней энергии частиц вещества. Твердое агрегатное состояние соли, которую используют в пищу, тоже можно изменить. Но чтобы расплавить поваренную соль, нужна более высокая температура, чем при нагревании сахара. Дело в том, что сахар состоит из молекул, а поваренная соль - из заряженных ионов, которые сильнее притягиваются друг к другу. Твердые вещества в жидком виде не сохраняют свою форму, потому что кристаллические решетки разрушаются.
Жидкое агрегатное состояние соли при расплавлении объясняется разрывом связи между ионами в кристаллах. Освобождаются заряженные частички, которые могут переносить электрические заряды. Расплавы солей проводят электричество, являются проводниками. В химической, металлургической и машиностроительной промышленности твердые вещества превращают в жидкие для получения из них новых соединений или придания им разной формы. Большое распространение получили сплавы металлов. Есть несколько способов их получения, связанных с изменениями агрегатного состояния твердого сырья.

Если налить в круглодонную колбу 50 мл воды, то можно заметить, что вещество сразу же примет форму химического сосуда. Но как только мы выльем воду из колбы, то жидкость сразу же растечется по поверхности стола. Объем воды останется тот же — 50 мл, а ее форма изменится. Перечисленные особенности характерны для жидкой формы существования материи. Жидкостями являются многие органические вещества: спирты, растительные масла, кислоты.
Молоко — эмульсия, т. е. жидкость, в которой находятся капельки жира. Полезное жидкое ископаемое — нефть. Добывают ее из скважин с помощью буровых вышек на суше и в океане. Морская вода тоже является сырьем для промышленности. Ее отличие от пресной воды рек и озер заключается в содержании растворенных веществ, в основном солей. При испарении с поверхности водоемов в парообразное состояние переходят только молекулы Н2О, растворенные вещества остаются. На этом свойстве основаны методы получения полезных веществ из морской воды и способы ее очистки.
При полном удалении солей получают дистиллированную воду. Она кипит при 100 °С, замерзает при 0 °С. Рассолы кипят и превращаются в лед при других температурных показателях. Например, вода в Северном Ледовитом океане замерзает при температуре на поверхности 2 °С.
Агрегатное состояние ртути при обычных условиях — жидкость. Этим серебристо-серым металлом обычно заполняют медицинские термометры. При нагревании столбик ртути поднимается по шкале, происходит расширение вещества. Почему же в уличных термометрах используется подкрашенный красной краской спирт, а не ртуть? Объясняется это свойствами жидкого металла. При 30-градусных морозах агрегатное состояние ртути меняется, вещество становится твердым.
Если медицинский термометр разбился, а ртуть вылилась, то собирать руками серебристые шарики опасно. Вредно вдыхать пары ртути, это вещество очень токсичное. Детям в таких случаях надо обратиться за помощью к родителям, взрослым.

Газы не способны сохранять ни свой объем, ни форму. Заполним колбу доверху кислородом (его химическая формула О2). Как только мы откроем колбу, молекулы вещества начнут смешиваться с воздухом в помещении. Это происходит благодаря броуновскому движению. Еще древнегреческий ученый Демокрит считал, что частички вещества находятся в постоянном движении. В твердых телах при обычных условиях у атомов, молекул, ионов нет возможности покинуть кристаллическую решетку, освободиться от связей с другими частицами. Такое возможно только при поступлении большого количества энергии извне.
В жидкостях расстояние между частицами немного больше, чем в твердых телах, им требуется меньше энергии для разрыва межмолекулярных связей. К примеру, жидкое агрегатное состояние кислорода наблюдается только при снижении температуры газа до −183 °C. При −223 °C молекулы О2 образуют твердое вещество. При повышении температуры сверх приведенных значений кислород превращается в газ. Именно в таком виде он находится при обычных условиях. На промышленных предприятиях действуют специальные установки для разделения воздуха атмосферы и получения из него азота и кислорода. Сначала воздух охлаждают и сжижают, а затем постепенно повышают температуру. Азот и кислород превращаются в газы при разных условиях.
Атмосфера Земли содержит 21 % по объему кислорода и 78 % азота. В жидком виде эти вещества в газовой оболочке планеты не встречаются. Жидкий кислород имеет светло-синий цвет, им при высоком давлении заполняют баллоны для использования в медицинских учреждениях. В промышленности и строительстве сжиженные газы необходимы для проведения очень многих процессов. Кислород нужен для газовой сварки и резки металлов, в химии — для реакций окисления неорганических и органических веществ. Если открыть вентиль кислородного баллона, давление уменьшается, жидкость превращается в газ.
Сжиженные пропан, метан и бутан находят широкое применение в энергетике, на транспорте, в промышленности и хозяйственно-бытовой деятельности населения. Получают эти вещества из природного газа или при крекинге (расщеплении) нефтяного сырья. Углеродные жидкие и газообразные смеси играют важную роль в экономике многих стран. Но запасы нефти и природного газа сильно истощены. По оценкам ученых, этого сырья хватит на 100–120 лет. Альтернативный источник энергии - воздушный поток (ветер). Используются для работы электростанций быстротекущие реки, приливы на берегах морей и океанов.

Кислород, как и другие газы, может находиться в четвертом агрегатном состоянии, представляя собой плазму. Необычный переход из твердого состояния в газообразное — характерная черта кристаллического йода. Вещество темно-фиолетового цвета подвергается сублимации — превращается в газ, минуя жидкое состояние.
Изменения агрегатного состояния веществ не связаны с химическими превращениями, это физические явления. При повышении температуры многие твердые тела плавятся, превращаются в жидкости. Дальнейшее повышение температуры может привести к испарению, то есть к газообразному состоянию вещества. В природе и хозяйстве такие переходы характерны для одного из главных веществ на Земле. Лед, жидкость, пар — это состояния воды при разных внешних условиях. Соединение одно и то же, его формула — Н2О. При температуре 0 °С и ниже этого значения вода кристаллизуется, то есть превращается в лед. При повышении температуры возникшие кристаллики разрушаются — лед тает, вновь получается жидкая вода. При ее нагревании образуется водяной пар. Испарение — превращение воды в газ — идет даже при низких температурах. Например, замерзшие лужи постепенно исчезают, потому что вода испаряется. Даже в морозную погоду мокрое белье высыхает, но только процесс этот более длительный, чем в жаркий день.
Все перечисленные переходы воды из одного состояния в другое имеют огромное значение для природы Земли. Атмосферные явления, климат и погода связаны с испарением воды с поверхности Мирового океана, переносом влаги в виде облаков и тумана на сушу, выпадением осадков (дождя, снега, града). Эти явления составляют основу Мирового круговорота воды в природе.

При обычных условиях сера — это яркие блестящие кристаллы или светло-желтый порошок, т. е. это твердое вещество. Агрегатное состояние серы меняется при нагревании. Сначала при повышении температуры до 190 °C желтое вещество плавится, превращаясь в подвижную жидкость.
Если быстро вылить жидкую серу в холодную воду, то получается коричневая аморфная масса. При дальнейшем нагревании расплава серы он становится все более вязким, темнеет. При температуре свыше 300 °C агрегатное состояние серы снова изменяется, вещество приобретает свойства жидкости, становится подвижным. Эти переходы возникают благодаря способности атомов элемента образовывать цепочки разной длины.
Агрегатное состояние серы — простого вещества — твердое при обычных условиях. Диоксид серы — газ, серная кислота — маслянистая жидкость тяжелее воды. В отличие от соляной и азотной кислот она не летучая, с ее поверхности не испаряются молекулы. Какое агрегатное состояние имеет пластическая сера, которую получают при нагревании кристаллов?
В аморфном виде вещество имеет структуру жидкости, обладая незначительной текучестью. Но пластическая сера одновременно сохраняет форму (как твердое вещество). Существуют жидкие кристаллы, обладающие рядом характерных свойств твердых веществ. Таким образом, состояние вещества при разных условиях зависит от его природы, температуры, давления и других внешних условий.

Имеющиеся различия между основными агрегатными состояниями материи объясняются взаимодействием между атомами, ионами и молекулами. Например, почему твердое агрегатное состояние вещества приводит к способности тел сохранять объем и форму? В кристаллической решетке металла или соли структурные частицы притягиваются другу к другу. В металлах положительно заряженные ионы взаимодействуют с так называемым «электронным газом» — скоплением свободных электронов в куске металла. Кристаллы солей возникают благодаря притяжению разноименно заряженных частиц — ионов. Расстояние между вышеперечисленными структурными единицами твердых тел намного меньше, чем размеры самих частиц. В этом случае действует электростатическое притяжение, оно придает прочность, а отталкивание недостаточно сильное.
Чтобы разрушить твердое агрегатное состояние вещества, надо приложить усилия. Металлы, соли, атомные кристаллы плавятся при очень высоких температурах. К примеру, железо становится жидким при температуре выше 1538 °С. Тугоплавким является вольфрам, из него изготавливают нити накаливания для электрических лампочек. Есть сплавы, которые становятся жидкими при температурах свыше 3000 °С. Многие горные породы и минералы на Земле находятся в твердом состоянии. Добывают это сырье с помощью техники в шахтах и карьерах.

Для отрыва даже одного иона от кристалла необходимо затратить большое количество энергии. Но ведь достаточно растворить соль в воде, чтобы кристаллическая решетка распалась! Это явление объясняется удивительными свойствами воды как полярного растворителя. Молекулы Н2О взаимодействуют с ионами соли, разрушая химическую связь между ними. Таким образом, растворение — это не простое перемешивание разных веществ, а физико-химическое взаимодействие между ними.
Вода может быть жидкостью, твердым веществом и газом (паром). Это ее основные агрегатные состояния при обычных условиях. Молекулы воды состоят из одного атома кислорода, с которым связаны два атома водорода. Возникает поляризация химической связи в молекуле, на атомах кислорода появляется частичный отрицательный заряд. Водород становится положительным полюсом в молекуле, притягивается атомом кислорода другой молекулы. Это слабое взаимодействие получило название «водородная связь».
Жидкое агрегатное состояние характеризуют расстояния между структурными частицами, сравнимые с их размерами. Притяжение существует, но оно слабое, поэтому вода не сохраняет форму. Парообразование происходит из-за разрушения связей, которое идет на поверхности жидкости даже при комнатной температуре.

Газообразное состояние вещества по ряду параметров отличается от жидкого и твердого. Между структурными частицами газов существуют большие промежутки, намного превышающие размеры молекул. При этом силы притяжения совсем не действуют. Газообразное агрегатное состояние характерно для веществ, присутствующих в составе воздуха: азота, кислорода, диоксида углерода. На рисунке ниже первый куб заполнен газом, второй жидкостью, а третий — твердым вещество.
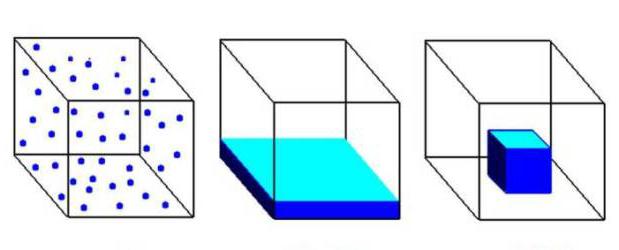
Многие жидкости являются летучими, с их поверхности отрываются и переходят в воздух молекулы вещества. Например, если к отверстию открытой бутылки с соляной кислотой поднести ватку, смоченную в нашатырном спирте, то появляется белый дым. Прямо в воздухе происходит химическая реакция между соляной кислотой и аммиаком, получается хлорид аммония. В каком агрегатном состоянии находится это вещество? Его частички, образующие белый дым, представляют собой мельчайшие твердые кристаллы соли. Этот опыт надо проводить под вытяжкой, вещества являются токсичными.
Агрегатное состояние газа изучали многие выдающиеся физики и химики: Авогадро, Бойль, Гей-Люссак, Клайперон, Менделеев, Ле-Шателье. Ученые сформулировали законы, объясняющие поведение газообразных веществ в химических реакциях, при изменении внешних условий. Открытые закономерности не только вошли в школьные и вузовские учебники физики и химии. Многие химические производства основаны на знаниях о поведении и свойствах веществ, находящихся в разных агрегатных состояниях.
fb.ru