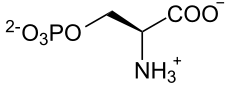

Простетической группой фосфопротеинов является ортофосфорная кислота. Остатки фосфорной кислоты присоединяются к молекуле белка сложноэфирными связями по месту гидроксильных групп оксиаминокислот – серина и треонина. Чаще всего в фосфопротеинах преобладает именно соединения фосфорной кислоты с серином.


Остаток фосфосерина Остаток фосфотреонина
В фосфопротеинах выявлены пирофосфатные и фосфодиэфирные остатки, наличие которых указывает на то, что пептидные цепи могут быть соединены не только дисульфидными мостиками,но и остатками фосфорной кислоты.
С биологической точки зрения фосфопротеины являются питательными веществами необходимыми для растущего организма. Прежде всего фосфопротеины вместе с необходимым пулом аминокислот участвуют в формирование скелета. Типичными представителями этих сложных белков являются казеины, существующие в нескольких формах и различающиеся между собой по содержанию фосфата и аминокислотным составом. Несколько различных фосфопротеинов найдено среди белков яиц: овальбумин – фосфопротеин яичного белка, вителленин и фосвитин, выделенные из яичного желтка. Ихтулин, обнаруженный в икре рыб, играет немаловажную роль в развитии эмбриона рыб. Пепсин, являясь протеолитическим ферментом, относится к фосфопротеинам и содержит одну молекулу фосфорной кислоты на одну молекулу этого белка. Фосфатная группа присоединяется к радикалу серина, находящемуся в пептидной цепи рядом с глутаминовой кислотой. Фосфопротеинами являются также ферменты фосфоглюкомутаза и фосфорилаза.
Липопротеины – высокомолекулярные структуры, большинство из которых являются транспортной формой липидов. Липопротеины состоят из белков и липидов (рис. 9.3). В отличие от липидов, липопротеины растворимы в воде и нерастворимы в органических растворителях. Прочность связи белков с липидами в липопротеинах неодинакова и зависит от того, есть ли в молекуле липида ионизированные группы атомов. Липопротеины широко представлены в плазме крови, нервной ткани, молоке, участвуют в построении плазматических мембран. Все типы липопротеинов имеют сходное строение: гидрофобное ядро и гидрофильный слой на поверхности. Гидрофильный слой образован белками, которые называют апопротеинами, и амфифильными молекулами липидов – фосфолипидов и холестерина. Гидрофильные группы этих молекул ориентированы в водную фазу, а гидрофобные части – к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды.
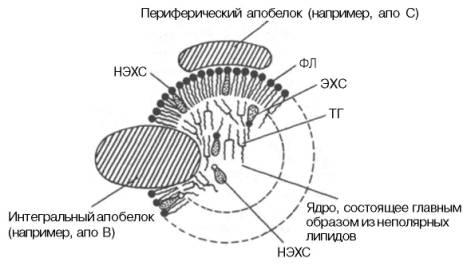
Рис. 9.3. Схема строения липопротеиновой частицы: НЭСХ – неэтерифицированный (свободный) холестерин, ЭХС – этерифицированный холестерин, ТГ – триацилглицеролы, ФЛ – фосфолипиды
Некоторые апопротеины интегральны и не могут быть отделены от липопротеина, а другие могут свободно переноситься от одного типа липопротеина к другому. В липопротеинах апопротеины выполняют несколько функций: формируют структуру липопротеина; взаимодействуют с рецепторами на поверхности клеток; определяют какими тканями будет захвачен липопротеин; служат ферментами или активаторами ферментов, действующих на липопротеин.
В организме синтезируются следующие липопротеины: хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП), см.табл. 9.1.
Таблица 9.1
Состав и некоторые характеристики липопротеинов плазмы крови
| Типы липопротеинов | Хиломикроны | ЛПОНП | ЛППП | ЛПНП | ЛПВП |
| Белки, % | 2 | 10 | 11 | 22 | 50 |
| ФЛ, % | 3 | 18 | 23 | 21 | 27 |
| ХС, % | 2 | 7 | 8 | 8 | 4 |
| ЭХС, % | 3 | 10 | 30 | 42 | 16 |
| ТАГ, % | 85 | 55 | 26 | 7 | 3 |
| Функции | Транспортирование липидов из клеток кишечника | Транспортирование липидов, синтезируемых в печени | Промежуточная форма превращения ЛПОНП в ЛПНП под действием фермента ЛП-липазы | Транспортироние холестерина в ткани | Удаление избытка холестерина из клеток и других липопротеинов |
| Место образования | Эпителий тонкого кишечника | Клетки печени | Кровь | Кровь | Клетки печени, ЛПВП-предшественники |
| Плотность, г/мл | 0,92-0,98 | 0,96-1,00 | – | 1,00-1,06 | 1,06-1,21 |
| Диаметр частиц, нМ | Больше 120 | 30-100 | – | 21-100 | 7-15 |
| Основные аполипопротеины | В 48,С 2, Е | В-100, С 2, Е | В-100, Е | В-100 | А-1, С-2, Е |
Функции апопротеинов следующие: В-48 – основной белок хиломикронов; В-100–основной белок ЛПОНП, ЛПНП, ЛППП, взаимодействующий с рецепторами ЛПНП; С-2 – активатор ЛП-липазы, переносится с ЛПВП на ХМ и ЛПОНП в крови; Е – взаимодействует с рецепторами ЛПНП; А – активатор фермента лецитин-холестеринтрансферазы (ЛХАТ).
Липопротеины хорошо растворимы в крови, не слипаются, т. к . имеют небольшой размер и отрицательный заряд на поверхности. Некоторые липопротеины легко проникают через стенки капилляров кровеносных сосудов и доставляют липиды к клеткам.
Хиломикроны, имеющие большие размеры, не могут преодолеть капилляры и поэтому сначала попадают в лимфатическую систему, а потом через главный грудной проток вливаются в кровь вместе с лимфой.
studfiles.net
§ 10. КЛАССИФИКАЦИЯ БЕЛКОВ
Существуют несколько подходов к классификации белков: по форме белковой молекулы, по составу белка, по функциям. Рассмотрим их.
Классификация по форме белковых молекул
По форме белковых молекул различают фибриллярные белки и глобулярные белки.
Фибриллярные белки представляют собой длинные нитевидные молекулы, полипептидные цепи которых вытянуты вдоль одной оси и скреплены друг с другом поперечными сшивками (рис. 18,б). Эти белки отличаются высокой механической прочностью, нерастворимы в воде. Они выполняют главным образом структурные функции: входят в состав сухожилий и связок (коллаген, эластин), образуют волокна шелка и паутины (фиброин), волосы, ногти, перья (кератин).
В глобулярных белках одна или несколько полипептидных цепей свернуты в плотную компактную структуру – клубок (рис. 18,а). Эти белки, как правило, хорошо растворимы в воде. Их функции многообразны. Благодаря им осуществляются многие биологические процессы, о чем подробнее будет изложено ниже.
Рис. 18. Форма белковых молекул:
а – глобулярный белок, б – фибриллярный белок
Классификация по составу белковой молекулы
Белки по составу можно разделить на две группы: простые и сложные белки. Простые белки состоят только из аминокислотных остатков и не содержат других химических составляющих. Сложные белки, помимо полипептидных цепей, содержат другие химические компоненты.
К простым белкам относятся РНКаза и многие другие ферменты. Фибриллярные белки коллаген, кератин, эластин по своему составу являются простыми. Запасные белки растений, содержащиеся в семенах злаков, – глютелины, и гистоны – белки, формирующие структуру хроматина, принадлежат также к простым белкам.
Среди сложных белков различают металлопротеины, хромопротеины, фосфопротеины, гликопротеины, липопротеины и др. Рассмотрим эти группы белков подробнее.
Металлопротеины
К металлопротеинам относят белки, в составе которых имеются ионы металлов. В их молекулах встречаются такие металлы, как медь, железо, цинк, молибден, марганец и др. Некоторые ферменты по своей природе являются металлопротеинами.
Хромопротеины
В составе хромопротеинов в качестве простетической группы присутствуют окрашенные соединения. Типичными хромопротеинами являются зрительный белок родопсин, принимающий участие в процессе восприятие света, и белок крови гемоглобин (Hb), четвертичная структура которого рассмотрена в предыдущем параграфе. В состав гемоглобина входит гем, представляющий собой плоскую молекулу, в центре которой расположен ион Fe2+ (рис. 19). При взаимодействии гемоглобина с кислородом образуется оксигемоглобин. В альвеолах легких гемоглобин насыщается кислородом. В тканях, где содержание кислорода незначительно, оксигемоглобин распадается с выделением кислорода, который используется клетками:
.
Гемоглобин может образовывать соединение с оксидом углерода (II), которое называется карбоксигемоглобином:
.
Карбоксигемоглобин не способен присоединять кислород. Вот почему происходит отравление угарным газом.
Гемоглобин и другие гем-содержащие белки (миоглобин, цитохромы) называют еще гемопротеинами из-за наличия в их составе гема (рис. 19).
Рис. 19. Гем
Фосфопротеины
Фосфопротеины в своем составе содержат остатки фосфорной кислоты, связанные с гидроксильной группой аминокислотных остатков сложноэфирной связью (рис. 20).
Рис. 20. Фосфопротеин
К фосфопротеинам относится белок молока казеин. В его состав входят не только остатки фосфорной кислоты, но и ионы кальция. Фосфор и кальций необходимы растущему организму в больших количествах, в частности, для формирования скелета. Кроме казеина, в клетках много и других фосфопротеинов. Фосфопротеины могут подвергаться дефосфорилированию, т.е. терять фосфатную группу:
фосфопротеин + Н2 протеин + Н3РО4
Дефосфорилированные белки могут при определенных условиях быть снова фосфорилированы. От наличия фосфатной группы в их молекуле зависит их биологическая активность. Одни белки проявляют свою биологическую функцию в фосфорилированном виде, другие – в дефосфорилированном. Посредством фосфорилирования – дефосфорилирования регулируются многие биологические процессы.
Липопротеины
К липопротеинам относятся белки, содержащие ковалентно связанные липиды. Эти белки встречаются в составе клеточных мембран. Липидный (гидрофобный) компонент удерживает белок в мембране (рис. 21).
Рис. 21. Липопротеины в клеточной мембране
К липопротеинам относят также белки крови, участвующие в транспорте липидов и не образующие с ними ковалентную связь.
Гликопротеины
Гликопротеины содержат в качестве простетической группы ковалентно связанный углеводный компонент. Гликопротеины разделяют на истинные гликопротеины и протеогликаны. Углеводные группировки истинных гликопротеинов содержат обычно до 15 – 20 моносахаридных компонентов, у протеогликанов они построены из очень большого числа моносахаридных остатков (рис. 22).
Рис. 22. Гликопротеины
Гликопротеины широко распространены в природе. Они встречаются в секретах (слюне и т.д.), в составе клеточных мембран, клеточных стенок, межклеточного вещества, соединительной ткани и т.д. Многие ферменты и транспортные белки являются гликопротеинами.
Классификация по функциям
По выполняемым функциям белки можно разделить на структурные, питательные и запасные белки, сократительные, транспортные, каталитические, защитные, рецепторные, регуляторные и др.
Структурные белки
К структурным белкам относятся коллаген, эластин, кератин, фиброин. Белки принимают участие в формировании клеточных мембран, в частности, могут образовывать в них каналы или выполнять другие функции ( рис. 23).
Рис. 23. Клеточная мембрана.
Питательные и запасные белки
Питательным белком является казеин, основная функция которого заключается в обеспечении растущего организма аминокислотами, фосфором и кальцием. К запасным белкам относятся яичный белок, белки семян растений. Эти белки потребляются во время развития зародышей. В организме человека и животных белки в запас не откладываются, они должны систематически поступать с пищей, в противном случае может развиться дистрофия.
Сократительные белки
Сократительные белки обеспечивают работу мышц, движение жгутиков и ресничек у простейших, изменение формы клеток, перемещение органелл внутри клетки. Такими белками являются миозин и актин. Эти белки присутствуют не только в мышечных клетках, их можно обнаружить в клетках практически любой ткани животных.
Транспортные белки
Гемоглобин, рассмотренный в начале параграфа, является классическим примером транспортного белка. В крови присутствуют и другие белки, обеспечивающие транспорт липидов, гормонов и иных веществ. В клеточных мембранах находятся белки, способные переносить через мембрану глюкозу, аминокислоты, ионы и некоторые другие вещества. На рис. 24 схематически показана работа переносчика глюкозы.
Рис. 24. Транспорт глюкозы через клеточную мембрану
Белки-ферменты
Каталитические белки, или ферменты, представляют собой самую многообразную группу белков. Почти все химические реакции, протекающие в организме, протекают при участии ферментов. К настоящему времени открыто несколько тысяч ферментов. Более подробно они будут рассмотрены в следующих параграфах.
Защитные белки
К этой группе относятся белки, защищающие организм от вторжения других организмов или предохраняющие его от повреждений. Иммуноглобулины, или антитела, способны распознавать проникшие в организм бактерии, вирусы или чужеродные белки, связываться с ними и способствовать их обезвреживанию.
Другие компоненты крови, тромбин и фибриноген, играют важную роль в процессе свертывания крови. Они предохраняют организм от потери крови при повреждении сосудов. Под действием тромбина от молекул фибриногена отщепляются фрагменты полипептидной цепи, в результате этого образуется фибрин:
фибриноген фибрин.
Образовавшиеся молекулы фибрина агрегируют, формируя длинные нерастворимые цепи. Сгусток крови вначале является рыхлым, затем он стабилизируется за счет межцепочечных сшивок. Всего в процессе свертывания крови участвует около 20 белков. Нарушения в структуре их генов является причиной такого заболевания, как гемофилия – сниженная свертываемость крови.
Рецепторные белки
Клеточная мембрана является препятствием для многих молекул, в том числе и для молекул, предназначенных для передачи сигнала внутрь клеток. Тем не менее клетка способна получать сигналы извне благодаря наличию на ее поверхности специальных рецепторов, многие из которых являются белками. Сигнальная молекула, например, гормон, взаимодействуя с рецептором, образует гормон-рецепторный комплекс, сигнал от которого передается далее, как правило, на белковый посредник. Последний запускает серию химических реакций, результатом которых является биологический ответ клетки на воздействие внешнего сигнала (рис. 25).
Рис.25. Передача внешних сигналов в клетку
Регуляторные белки
Белки, участвующие в управлении биологическими процессами, относят к регуляторным белкам. К ним принадлежат некоторые гормоны. Инсулин и глюкагон регулируют уровень глюкозы в крови. Гормон роста, определяющий размеры тела, и паратиреоидный гормон, регулирующий обмен фосфатов и ионов кальция, являются регуляторными белками. К этому классу белков принадлежат и другие протеины, участвующие в регуляции обмена веществ.
Интересно знать! В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
ebooks.grsu.by
В состав многих белков помимо пептидных цепей входят и неаминокислотные фрагменты, по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки содержат только аминокислотные цепи, сложные белки содержат также неаминокислотные фрагменты. Эти фрагменты в составе сложных белков называются «простетическими группами». В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы:
Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и протеогликаны, с мукополисахаридными простетическими группами. Большая часть внеклеточных белков, иммуноглобулины — гликопротеиды. Протеогликаны являются основным компонентом межклеточного матрикса.
Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды выполняют функцию транспорта липидов.
Металлопротеиды, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (ферритин и трансферрин) и ферменты (карбоангидраза и различные супероксиддисмутазы) Как правило, металлопротеины - ферменты.
Нуклеопротеиды, содержащие нековалентно связанные ДНК или РНК. Составные части клеточных ядер. Нуклеопротеиды являются важнейшей составной частью вирусов.
Фосфопротеиды, содержащие ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются казеин молока. Большое количество их содержится в ЦНС. Многие важные ферменты клетки активны только в фосфорилированной форме. Фосфопротеины являются источником энергетического и пластического материала.
Хромопротеиды. К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины, хлорофиллы; флавопротеиды с флавиновой группой, и др.
Альбумины и глобулины крови, их физико-химические свойства, функции.
1 .По функции выделяют:
1. Транспортные белки (гемоглобин О2, альбумин жирные кислоты).
2. Каталитические (ферменты),
3. Регуляторные (гормоны).
4. Структурные (белки соединительной ткани, мембранные белки).
5. Защитные (антитела).
6. Сократительные (актин, миозин).
7. Рецепторные участвуют в образовании рецепторов.
2. По форме выделяют:
1. Глобулярные.
Фибриллярные белки
Просты́е белки́ — белки, которые построены из остатков α-аминокислот и при гидролизе распадаются только на аминокислоты.
Простые белки по растворимости в воде и солевых растворах условно подразделяются на: протамины, гистоны, альбумины, глобулины, проламины, глютелины.
Простые белки по растворимости и пространственному строению разделяют на глобулярные и фибриллярные. Глобулярные белки отличаются шарообразной формой молекулы, растворимы в воде. К этой группе относятся все ферменты и БАВ.
Среди глобулярных белков можно выделить:
альбумины — растворимы в воде в широком интервале рН ( 4 -8,5), осаждаются 70-100% раствором сульфата аммония;
полифункциональные глобулины с большей молекулярной массой, труднее растворимы в воде, растворимы в солевых растворах, часто содержат углеводную часть;
гистоны — низкомолекулярные белки с высоким содержанием в молекуле остатков аргинина и лизина, что обусловливает их основные свойства;
протамины отличаются еще более высоким содержанием аргинина (до 85 %), как и гистоны, образуют устойчивые ассоциаты с нуклеиновыми кислотами, выступают как регуляторные и репрессорные белки — составная часть нуклеопротеинов;
проламины характеризуются высоким содержанием глутаминовой кислоты (30-45 %) и пролина (до 15 %), нерастворимы в воде, растворяются в 50-90 % этаноле;
глутелины содержат около 45 % глутаминовой кислоты, как и проламины, чаще содержатся в белках злаков.
Фибриллярные белки характеризуются волокнистой структурой, практически нерастворимы в воде и солевых растворах. Полипептидные цепи в молекулах расположены параллельно одна другой. Участвуют в образовании структурных элементов соединительной ткани (коллагены, кератины, эластины).
studfiles.net

МОДУЛЬ I. СТАТИЧЕСКАЯ БИОХИМИЯ
Лекция 8 Классификация белков. простые и сложные белки
Представляют собой комплекс белков с жирами (рис.8.1). Разные фракции липопротеинов в сыворотке осуществляют транспорт жиров в организме. Кроме того, липопротеины могут входить в состав клеточных мембран, внутриклеточных образований, оболочек нервов.
Рис. 8.1. Структура липопротеинов низкой плотности
В состав гликопротеинов входят углеводные компоненты гетероолигосахаридные цепи, содержащие от двух до десяти, реже 15 мономерных остатков гексоз (галактоза и манноза, реже глюкоза), пентоз (ксилоза, арабиноза) и конечный углевод, чаще всего представленный N- ацетилгалактозамином, L-фукозойили сиаловой кислотой. В отличие от протеогликанов гликопротеины не содержат уроновых кислот и серной кислоты.
Некоторые белки этой группы встречаются в слизистых соединениях животных организмов и обусловливают свойства этих выделений тянуться в нити даже при сравнительно большом разбавлении. Эти белки образуются в подчелюстной железе (подчелюстная железа одна из слюнных желез), печени, железах желудка и кишечника. Другие гликопротеины находятся в хрящах, яичном белке, стекловидном теле глаза и т.д. К типичным гликопротеинам относят большинство белковых гормонов, мембранные сложные белки, все антитела (иммуноглобулины), белки плазмы крови, молока, овальбумин, интерфероны, факторы комплемента, группы крови, рецепторные белки и др.
Гликопротеины выполняют специфические функции: обеспечивают клеточную адгезию, молекулярное и клеточное узнавание, антигенную активность опухолевых клеток, оказывают защитное и гормональное, а также антивирусное действие (рис.8.2).
Биохимия и молекулярная биология. Конспект лекций | -71- |

МОДУЛЬ I. СТАТИЧЕСКАЯ БИОХИМИЯ
Лекция 8 Классификация белков. простые и сложные белки
Рис. 8.2. Гликопротеин (иммуноглобулин М)
Протеогликаны состоят из белка и гликозаминогликанов. Наибольшее количество протеогликанов содержится в соединительной ткани животных, где эти вещества, в первую очередь, протеохондроитинсульфаты и протеодерматансульфаты, в комплексе с гиалуроновой кислотой, коллагеном и некоторыми другими белками обеспечивают необходимые физикомеханические свойства таких образований, как кости, сухожилия, хрящи, межпозвоночные диски, кожа, стенки кровеносных сосудов, роговица, стекловидное тело глаза и др.
Протеогепарансульфаты – компоненты клеточной поверхности во многих типах тканей и участвуют в обеспечении специфической клеточной адгезии и защите клеток от повреждения при инфекциях (рис.8.3). Протеогепарин синтезируется и накапливается в специализированных («тучных») клетках, продукты его ферментативного расщепления являются природными регуляторами процесса свертывания крови (антикоагулянтами). Нарушения биосинтеза или катаболизма протеогликанов вызывают ряд тяжелых заболеваний (нарушение зрения и функцийкостно-суставногоаппарата, воспалительные артриты, атеросклероз и др.).
Биохимия и молекулярная биология. Конспект лекций | -72- |

МОДУЛЬ I. СТАТИЧЕСКАЯ БИОХИМИЯ
Лекция 8 Классификация белков. простые и сложные белки
Рис.8.3. Схематическое изображение структур протеогликанов: 1 − протеогликан хряща, 2 − протеогепарин; 3 − протеодерматансульфат с олигосахаридами муцинового типа, 4 − протеохондроитинсульфат или протеодерматансульфат небольшой молекулярной массы, 5 протеокератансульфат роговицы; 6 протеогепарансульфат клеточной поверхности
Содержат в своем составе фосфор, имеют определенно выраженный кислотный характер. Главным представителем фосфопротеинов является казеин молока. Он обладает настолько ясно выраженным кислотным характером, что разлагает углекислые соли с выделением углекислого газа. Казеин растворяется в слабых растворах щелочей, образуя с ними соли. Соли казеина называются казеинатами. При нагревании казеин не свертывается. При действии кислот на соли казеина он выделяется в свободном виде. Этим объясняется свертывание молока при прокисании.Казеин содержит фосфор в виде сложного эфира фосфорной кислоты.Вителлин находится в желтке куриного яйца.
В своем составе сдержат ионы одного или нескольких металлов. Выполняют функцию транспорта и хранения металлов в организме (например, ферритин, в отличие от гемоглобина, участвует в транспорте и депонировании железа в организме). К металлопротеинам относится и ряд ферментов. Например, супероксиддисмутаза −Сu,Zn-СОД,в которой Zn выполняет структурную функцию, Cu – каталитическую.
Биохимия и молекулярная биология. Конспект лекций | -73- |

МОДУЛЬ I. СТАТИЧЕСКАЯ БИОХИМИЯ
Лекция 8 Классификация белков. простые и сложные белки
Находятся в клеточных ядрах. Выполняют структурную и регуляторную функции. При осторожном гидролизе они расщепляются на белок и нуклеиновую кислоту (рис.8.4). Нуклеиновые кислоты являются весьма сложными веществами, расщепляющимися при гидролизе на фосфорную кислоту, углеводы и азотосодержащие органические вещества группы пиримидина и группы пурина.
В природе обнаружено 2 типа нуклеопротеинов, отличающихся друг от друга по составу, размерам и физико-химическимсвойствам,: дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП).
Рис. 8.4. Модель вируса мозаичной болезни табака, а спираль РНК; б субъединицы белка
Хромопротеины – белки, имеющие в качестве простетической группы окрашенное вещество. Из хромопротеинов наиболее изучены гемоглобин,
миоглобин, цитохромы, хлорофилл.
Красящее вещество красных кровяных телец эритроцитов. Гемоглобин представляет собой соединение белка глобина с гемохромогеном (рис.8.5). Гемоглобин, соединяясь с кислородом, превращается в оксигемоглобин, который, отдавая свой кислород другим веществам, снова превращается в гемоглобин. Гемоглобин играет роль переносчика кислорода от легких к тканям. Образовавшийся в легких оксигемоглобин кровью разносится по телу и, отдавая свой кислород, способствует протеканию в организме окислительных процессов. Кроме того, гемоглобин вместе с плазмой крови осуществляет регуляцию величины рН крови и перенос углекислоты в организме.
Характерной особенностью гемоглобина является его способность соединяться с окисью углерода, после чего он теряет способность соединяться с кислородом. Этим объясняется ядовитое действие окиси углерода.
Биохимия и молекулярная биология. Конспект лекций | -74- |

МОДУЛЬ I. СТАТИЧЕСКАЯ БИОХИМИЯ
Лекция 8 Классификация белков. простые и сложные белки
Рис.8.5. Гемоглобин: а – олигомер гемоглобина; б – субъединица гемоглобина; в – структура гема
Вне организма гемоглобин, при действии воздуха, превращается в метгемоглобин, который отличается от оксигемоглобина прочностью связи с кислородом. При обработке ледяной уксусной кислотой метгемоглобин расщепляется с образованием глобина и гематина. При обработке метгемоглобина тем же реактивом, но в присутствии NаСl, получается хлористая соль гематина, называемая гемином. Гемин образует характерные красно-коричневыеромбики, которые позволяют обнаружить открыть присутствие крови в пятнах даже через несколько лет. Гематин очень близок гемохромогену, но все же отличается от него.
Белковая структура гемоглобина более сложна. Гемоглобин млекопитающих (в том числе человека) имеет молекулярную массу 64500 Да и состоит из четырех полипептидных цепей, каждая из которых содержит свой собственный гем. Преобладающая форма гемоглобина у взрослых людей – гемоглобин А – имеет две пары полипептидных цепей (α-цепей,каждая из которых состоит из 141 аминокислотного остатка, иβ-цепей– по 146 остатков в каждой). Несмотря на то, что аминокислотные последовательности полипептидных цепей гемоглобина и миоглобина в значительной степени различаются; – трехмерные структуры их сходны и гемы в молекулах того и другого занимают гидрофобные полости внутри свернутых полипептидных цепей.
Биохимия и молекулярная биология. Конспект лекций | -75- |

МОДУЛЬ I. СТАТИЧЕСКАЯ БИОХИМИЯ
Лекция 8 Классификация белков. простые и сложные белки
Четыре полипептидные цепи гемоглобина ассоциированы в тетраэдрическую структуру и образуют сферическую молекулу. Каждая из α-цепейконтактирует с двумяβ-цепями,в то время как между двумяα-цепямиили между двумяβ-цепямивзаимодействие почти отсутствует. Каждый из четырех гемов гемоглобина способен присоединить одну молекулу кислорода. Кислородсодержащая форма гемоглобина называетсяоксигемоглобином, а форма, не содержащая кислорода, –дезоксигемоглобином. Когда дезоксигемоглобин поглощает кислород, в его трехмерной структуре происходит ряд изменений, главным образом перемещение атома Fe2+ в плоскость системы колец гема. Как и в случае миоглобина, окисление Fe2+ до Fe3+ приводит к образованию неактивной формы гемоглобина метгемоглобина, который не способен присоединять молекулярный кислород.
Способность обратимо образовывать комплексы с кислородом обусловливает жизненно важную роль гемоглобина как переносчика кислорода у животных. Способность артериальной крови переносить кислород в присутствии гемоглобина в 70 раз выше, чем в его отсутствие.
Характерные особенности связывания кислорода гемоглобином:
1)кривая связывания освобождения кислорода гемоглобином имеет сигмоидную форму, что свидетельствует о том, что связывание кислорода гемом кооперативный процесс, т.е. связывание кислорода одним гемом облегчает его связывание другими генами;
2)сродство гемоглобина к кислороду зависит от величины рН и содержания СО2;
3)органические фосфаты, особенно 2,3-дифосфоглицерат(2,3-ДФГ),также оказывают влияние на сродство гемоглобина к кислороду.
Аллостерические свойства гемоглобина обусловлены взаимодействием четырех субъединиц его молекулы. При связывании кислорода происходит перемещение атома железа гема в плоскость гема оксигемоглобина, а проксимальный гистидин приближается к кольцу гема. Такое перемещение вызывает последующие небольшие изменения третичной структуры субъединицы, в частности, изменяется положение тирозинового остатка и смежной С-концевойаминокислоты. В результате исчезают некоторые взаимодействия между субъединицами и четвертичная структура дестабилизируется. При этом изменяется конформация других субъединиц, что облегчает связывание ими кислорода. И, наоборот, освобождение кислорода одним из гемов приводит к изменениям конформации и взаимодействия между субъединицами, что облегчает освобождение кислорода другими гемами.
С понижением значения рН освобождение О2 гемоглобином упрощается. То же самое происходит при повышении концентрации СО2. Это важно с физиологической точки зрения, т.к. в тканях с быстро протекающим обменом веществ образуется много СО2 и кислот. Высокие уровни СО2 и Н+ стимулируют освобождение О2 из гемоглобина, и таким образом удовлетворяется потребность в большом количестве кислорода. После освобождения кислорода дезоксигемоглобин присоединяет Н+ и СО2. Для альвеолярных капилляров
Биохимия и молекулярная биология. Конспект лекций | -76- |

МОДУЛЬ I. СТАТИЧЕСКАЯ БИОХИМИЯ
Лекция 8 Классификация белков. простые и сложные белки
легких характерна высокая концентрация кислорода, и там по мере связывания кислорода дезоксигемоглобином происходит освобождение Н+ и СО2.
Структурные превращения, которые претерпевает молекула гемоглобина, были подробно изучены. При переходе от оксигемоглобина к дезоксигемоглобину в результате конформационных изменений карбоксилсодержащие аминокислотные остатки приближаются к некоторым гистидиновым остаткам и концевым Nh3-группам.С изменением локального заряда микроокружения повышается величинарК кислого остатка и таким образом возрастает его сродство кНСО3-,которая значительно легче связывается с дезоксигемоглобином, чем с оксигемоглобином. Она связывается с концевой Nh3- группой каждой цепи с образованием карбаминопроизводных.
У человека 2,3-дифосфоглицератснижает сродство гемоглобина к кислороду в 26 раз. Это важно с физиологической точки зрения, поскольку в отсутствие этого механизма гемоглобину было бы трудно освобождать много кислорода в капиллярах тканей. Такое действие2,3-дифосфоглицератаобусловлено его способностью связываться с дезоксигемоглобином, а не с оксигемоглобином.2,3-ДФГсвязывается с гемоглобиновым тетрамером, располагаясь в центральном пространстве, в непосредственной близости от всех четырех субъединиц. Связывание2,3-дифосфоглицератаи О2 – взаимоисключающие процессы. В ходе оксигенации конформационные изменения приводят к значительному уменьшению центрального пространства в гемоглобиновом тетрамере и молекула2,3-дифосфоглицератавытесняется. При этом необходимо нарушение2,3-дифосфоглицерат-белковоговзаимодействия, что затрудняет связывание кислорода гемоглобином. Для поглощения 2,3- дифосфоглицерата требуется расщепление связигемоглобин-О2,так что 2,3- дифосфоглицерат упрощает высвобождение кислорода.
Сродство гемоглобина к окиси углерода больше, чем к кислороду; следовательно, СО может вытеснять кислород из оксигемоглобина. Образующийся карбоксигемоглобин не способен служить переносчиком кислорода, и поэтому окись углерода является весьма эффективным ядом. Карбоксигемоглобин имеет вишневокрасную окраску, характерную для цвета лица людей, отравившихся окисью углерода, что позволяет легко диагностировать отравление. Функционирование гемоглобина могут серьезно нарушать различные лекарственные препараты. Продукты метаболизма ацетанилида, фенацетина и некоторых других индуцируют окисление гемоглобина до Fе3+-формы,приводя к серьезному снижению кислородпереносящей способности крови.
Так же, как и у большинства других животных, у человека на разных стадиях развития организма имеются различные типы гемоглобина в крови. Гемоглобин плода и гемоглобин взрослого человека различаются по спектрам поглощения света и электрофоретическим свойствам. В крови зародыша на ранних стадиях его развития присутствует гемоглобин третьего типа. Зародышевый гемоглобин F обладает более высоким сродством к кислороду, чем гемоглобин А взрослых людей. Благодаря этому возможен оптимальный перенос кислорода от гемоглобина А матери к гемоглобину F плода. Более
Биохимия и молекулярная биология. Конспект лекций | -77- |
studfiles.net
Инозитол — универсальный компонент большинства живых организмов, где он находится как в свободном состоянии, так и в связанном — в виде фосфорных эфиров, фосфолипидов и фосфопротеинов. Он является незаменимым фактором роста дрожжей, участвует [c.275]
Ортофосфорная кислота в фосфопротеинах обычно ковалентно связана [c.532]ФОСФОПРОТЕИДЫ (фосфопротеины), сложные белки, содержащие остатки фосфорной к-ты, присоединенные, как правило, фосфоэфирной связью к остаткам a-aMHHO- -окси-кислоты— серина (фосфосерин) или треонина (фосфотрео-нин). Образуются в результате катализируемого ферментом протеинкиназой переноса фосфата АТФ на гидроксильную группу к-ты в уже сформированной молекуле белка. Образование Ф. и их расщепление ферментом ФП-фосфа-тазой играют большую роль в гормональной регуляции активности мн. ферментов, напр, гликоген-синтетазы и глико-ген-фосфорилазы. [c.628]
От обычных белков, состоящих исключительно из протеиногенных аминокислот, следует отличать сложные белки, называемые также конъюгированными белками или протеидами. Это вещества, содержащие помимо белковой части небелковый органический или неорганический компонент, необходимый для функционирования, могущий быть связанным с полипептидной цепью ковалентно, гетерополярно или координационно и вместе с аминокислотами присутствующий в гидролизате. Важнейшие представители сложных белков гликопроТеины (простетическая группа — нейтральные сахара (галактоза, манноза, фукоза), аминосахара (N-aцeтилглюкoзa-мин, N-aцeтилгaлaктoэaмин) или кислые производные моносахаридов (уро-новые или сиаловые кислоты)), липопротеины, содержащие триглицериды, фосфолипиды и холестерин, металлопротеины с ионом металла, связанным ионной или координационной связью, фосфопротеины, связанные эфирной связью через остаток серина или треонина с фосфорной кислотой, нуклеопротеины, ассоциирующиеся с нуклеиновыми кислотами в рибосомах или вирусах, а также хромопротеины, содержащие в качестве просте-тической группы окрашенный компонент. Обзор структур важнейших белков см. в разд. 3.8. [c.345]
Фосфопротеины в головном мозге содержатся в большем количестве, чем в других органах и тканях,— около 2% от общего количества всех сложных белков мозга. Фосфопротеины обнаружены в мембранах различных морфологических структур нервной ткани. [c.630]
Фосфопротеины в качестве простетической группы содержат ортофосфор-ную кислоту связанную с гидроксилом серина или треонина. К фосфопро-теинам относятся многие питательные белки, например основной белок молока — казеин, который кроме фосфорной группы имеет также в своем составе углеводный компонент. Белок яичного желтка — вителлин, икры рыб — ихту-лин. [c.49]
Влияние молочной диеты на pH мочи. При исключительно молочной диете pH мочи становится ниже (pH цельного молока равен 7,5. Попытайтесь объяснить этот парадокс, учитывая общий состав молока, где примерно 3,5% приходится на долю лактозы, 3,5%-на жир и около 3,5%-на казеин (фосфопротеин, содержащий много остатков серинфосфата). [c.778]
В составе органической части почвы соединения фосфора представлены фосфолипидами — около 1 % органического фосфора, ино-зитолфосфатами и нуклеиновыми кислотами — 2—3 % органического фосфора, фосфопротеинами, сахарофосфатами, фосфорилированны-ми карбоновыми кислотами. До 60 % органического фосфора представлено инозитолфосфатами инозит, или шестиатомный насыщенный спирт гексаоксициклогексан имеет следующую структурную формулу [c.61]
Переход менее активной гликоген-син-тазы Ь обратно в активную форму катализируется фосфопротеин-фосфатазой, которая отщепляет фосфатные группы от остатков серина [c.615]
Простые белки в свою очередь делятся на основании некоторых условно выбранных критериев на ряд подгрупп протамины, гистоны, альбумины, глобулины, проламины, глютелины и др. Классификация сложных белков (см. главу 2) основана на химической природе входящего в их состав небелкового компонента. В соответствии с этим различают фосфопротеины (содержат фосфорную кислоту), хромопротеины (в состав их входят пигменты), пуклеопротеины (содержат нуклеиновые кислоты), гликопротеины (содержат углеводы), липопротеины (содержат липиды) и металлопротеины (содержат металлы). [c.72]
Новые данные свидетельствуют о том, что в клетках фосфопротеины синтезируются в результате посттрансляционной модификации, подвергаясь фосфорилированию при участии протеинкиназ. Этот процесс подробно рассматривается в главе 14. Здесь лишь укажем на существенную роль специфической протеинкиназы, катализирующей фосфорилирование ОН-группы тирозина, в биосинтезе онкобелков. Таким образом, уровень фосфопротеинов в клетке зависит в значительной степени от регулирующего действия ферментов, катализирующих фосфорилирование (протеинкиназы) и дефосфорилирование (протеинфосфатазы). Следует отметить, что фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функций. Кроме того, они являются ценным источником энергетического и пластического материала в процессе эмбриогенеза и дальнейшего постна-тального роста и развития организма. [c.90]
Серин легко превращается в пируват под действием сериндегидратазы. В связи с этим в тканях имеются условия для превращения глицина (через серин) в пируват. Этим путем осуществляется участие глицина в обмене углеводов. Важную роль играет серин в биосинтезе сложных белков — фосфопротеинов, а также фосфоглицеридов. Помимо фосфатидилсерина, углеродный скелет и азот серина используются в биосинтезе фосфатидилэтаноламина и фосфатидилхолина (см. главу 11). [c.453]
Белковые вещества пентозных дрожжей представлены протеинами (нуклеопротеин, фосфопротеин, лецитопротеин, гликопротеин), глобулинами, альбуминами и более простыми — пептонами, полипептидами и аминокислотами. Анализ белка хроматографическим методом показал, что он содержит все жизненно необходимые аминокислоты. Количество их- в пентозных дрожжах следующее (в % от сухого вещества) [c.572]
Примерами сложных белков могут служить транспортные белки миоглобин и гемоглобин, в которых белковая часть — глобин — соединена с простетической группой — г е м о м. По типу простетической группы их относят к гемопротеинам. Фосфопротеины содержат остаток фосфорной кислоты, металлопротеины — ионы металла. [c.376]
Ннколе, Шинн н Зайдель [479] сообщили, что серии, связанный с фосфорной кислотой в казеине, вителлине и других белках, разрушается во время кислотного гидролиза. Поэтому они предлагают предварительно нагревать фосфопротеин 24 часа при 37 с избытком 0,25 н. NaOH для разрушения связи с фосфорной кислотой, а затем уже проводить обычный кислотный гидролиз. [c.259]
Фосфопротеины. Белки кислого характера содержащие эфирносвязанную с остатком серина фосфорную кислоту. Фосфорная кислота отщепляется при нагревании в щелочных растворах. Содержание фосфора 0,5—0,9%. Фосфопротеины нерастворимы в воде, но растворимы в разбавленных щелочах. Осаждаются при полунасыщении сернокислым аммонием. К фосфопротеинам относятся казеин молока и вителлин яичного желтка. [c.176]
ФОСФОПРОТЕИДЫ (фосфопротеины, ФП) — сложные белки, содержащие фосфорильную группу, присоединенную к аминокислотным остаткам пептидной цепп. Местом присоединения фосфорильного остатка в Ф. служат оксиаминокислоты — серии и треонин. При действии щелочи Ф. сравнительно легко гидролизуются с отщенлением фосфорильной группировки к действию кислот Ф. устойчивы. Ферментативный гидролиз Ф. осуществляется под действием специфич. фермента — фосфопротеинфос-фатазы обратная реакция — образование Ф. катализируется ферментом иротеинфосфокиназой. При этом происходит перенос остатков фосфорной к-ты от аденозинтрифосфорпой к-ты (АТФ) на остатки [c.244]
Сравнительно недавно в ткани этой же железы найдены еще две аминокислоты, близкие по строению к дийодтирозину и тироксину, — монойодтирозин и трийодтиронин. Являются ли они предшественниками или продуктами распада тироксина и дий-одтирозина — пока неизвестно. Наконец, в фосфопротеинах обнаружены производные оксиаминокислот, получившие названия фосфосерина и фосфотреонина. Остаток фосфорной кислоты в них присоединяется эфирной связью к оксигруппе аминокислоты [c.53]
Помимо ассоциаций боковых неполярных радикалов и дисульфидных мостиков в создании третичной структуры могут принимать участие и другие ковалентные связи — например, фосфо-эфирная. Показано, что в пепсине и а-казеине, встречаются ортофосфатные связи, соединяющие, вероятно, остатки серина и треонина доказано также наличие фосфоамидной поперечной связи (О—РОг—NH—) в а-казеине, которая присоединена, по-видимому, к остаткам лизина и аргинина. Возможно, что подобного рода связи имеют место и в фосфопротеинах. Однако для других белков они не имеют существенного значения. [c.94]
Биологическая химия Изд.3 (1998) -- [ c.89 , c.90 , c.630 ]Большой энциклопедический словарь Химия изд.2 (1998) -- [ c.628 ]
Основы биохимии Т 1,2,3 (1985) -- [ c.142 ]
Химия органических лекарственных препаратов (1949) -- [ c.418 , c.422 ]
Пептиды Том 2 (1969) -- [ c.373 ]
Биология Том3 Изд3 (2004) -- [ c.0 ]
Биохимия человека Т.2 (1993) -- [ c.164 , c.165 ]
Биохимия человека Том 2 (1993) -- [ c.164 , c.165 ]
Физиология растений Изд.3 (1988) -- [ c.40 ]
Биологическая химия (2004) -- [ c.38 , c.92 , c.94 ]
chem21.info