Содержание
3.2 Классификация белков молока
В
молоке
содержится в среднем около 3,2%
белков, колебания составляют от 2,9% до
3,5%. Белки,
входящие
в состав молока, имеют сложный состав,
разнообразны по строению, физико-химическим
свойствам и биологическим функциям.
Используя
современные способы разделения и
выделения белков, исследователи
установили, что в состав молока входят
три группы белков:
На рис. 4 представлен
фракционный состав белков молока.
Биологические
функции белков молока многообразны.
Так, казеин является
собственно пищевым белком, выполняющим
в организме новорожденного
структурную функцию. Кроме того, казеин
транспортирует в составе
своих частиц кальций, фосфор и магний.
Транспортные функции также выполняют
лактоферрин и β-лактоглобулин,
иммуноглобулины обладают
защитными функциями, α-лактальбумин —
регуляторными и т. д.
Общий белок 3,2%
Подкисление, рН
4,6
Осадок:
Фильтрат:
казеин
2,6% сывороточные
белки 0,6%
Нагревание
до 93-95°С,
раскисление
Осадок:
Фильтрат:
лактоферрин,
β-лактоглобулин, протеоз-пептоны
0,06%
иммуноглобулины,
α-лактальбумин
0,54%
действие
трихлоруксусной
кислоты
Рис. 4. Схема
4. Схема
фракционного состава белков молока
Казеин
является главным белком молока, его
содержание колеблется от
2,1 до 2,9%. Элементарный состав казеина
(в %) следующий: углерод — 53,1;
водород — 7,1; кислород — 22,8; азот — 15,4; сера
— 0,8; фосфор — 0,8.
Он содержит несколько фракций, отличающихся
аминокислотным
составом, отношением к ионам кальция и
сычужному ферменту.
В
молоке казеин находится в виде
специфических частиц, или мицелл,
представляющих собой сложные комплексы
фракций казеина с коллоидным фосфатом
кальция.
Казеин – комплекс
4 фракций: αs1,
αs2,
β,
χ. Фракции имеют различный аминокислотный
состав и отличаются друг от лруга заменой
одного или двух аминокислотных остатков
в полипептидной цепи. αs— и β –
Казеины наиболее чувствительны к ионам
кальция и в присутствии их они агрегируют
и выпадают в осадок. χ — Казеин не
осаждается ионами кальция и в казеиновых
мицеллах, располагаясь на поверхности,
выполняет защитную роль по отношению
к чувствительным .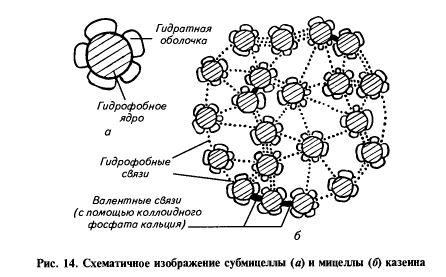 αs— и β –
αs— и β –
казеину. Однако χ – казеин чувствителен
к сычужному ферменту и под его воздействием
распадается на 2 части: гидрофобный пара
-χ-казеин и гидрофильный макропротеид.
Полярные
группы, находящиеся на поверхности и
внутри казеиновых мицелл (NH2,
COOH,
ОН и др.), связывают
значительное количество воды — около
3,7 г на 1 г белка. Способность
казеина связывать воду характеризует
его гидрофильные
свойства.
Гидрофильные
свойства казеина зависят от структуры,
величины заряда
белковой молекулы, рН среды, концентрации
солей и других факторов.
Они имеют большое практическое значение.
От
гидрофильных свойств казеина зависит
устойчивость казеиновых мицелл
в молоке. Гидрофильные
свойства казеина
влияют на способность кислотного и
кислотно-сычужного сгустка
удерживать и выделять влагу. Изменение
гидрофильных свойств казеина
необходимо учитывать при выборе режима
пастеризации в процессе производства
кисломолочных продуктов и молочных
консервов. От гидрофильных свойств
От гидрофильных свойств
казеина и продуктов его распада зависят
водосвязывающая
и влагоудерживающая способность сырной
массы при созревании сыров, консистенция
готового продукта.
Казеин
в молоке содержится в виде сложного
комплекса казеината
кальция с коллоидным фосфатом кальция,
так называемого казеинаткальцийфосфатного
комплекса (ККФК). В состав ККФК также
входит небольшое количество лимонной
кислоты, магния, калия и натрия.
Основные функции белков в организме, их свойства и роль
Что такое белки
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью.
Этот класс органических веществ можно рассматривать с точки зрения двух наук: биологии и химии. Начнем с биологической роли белков.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Запишитесь и участвуйте в розыгрыше 8 уроков
Биологические функции белков
Строительная, или пластическая
Белки являются основой структурного материала всех клеточных мембран, так как образуют основу протоплазмы любой живой клетки. Наверняка вам известны такие белки, как коллаген, кератин и эластин. Именно они составляют основу соединительной ткани организма и обеспечивают ее прочность.
Транспортная
Эта функция заключается в присоединении химических элементов или биологически активных веществ, то есть гормонов, и в перемещении их к различным тканям и органам тела. Например, гемоглобин является переносчиком кислорода в крови, а также принимает участие в транспорте углекислого газа. Перенос насыщенных жирных кислот в крови по организму происходит при участии альбумина. Трансферрин переносит ионы железа, а особые белки участвуют в переносе ионов натрия и калия через мембрану клетки.
Регуляторная
Белки играют роль в регуляции и согласовании обмена веществ в различных клетках организма.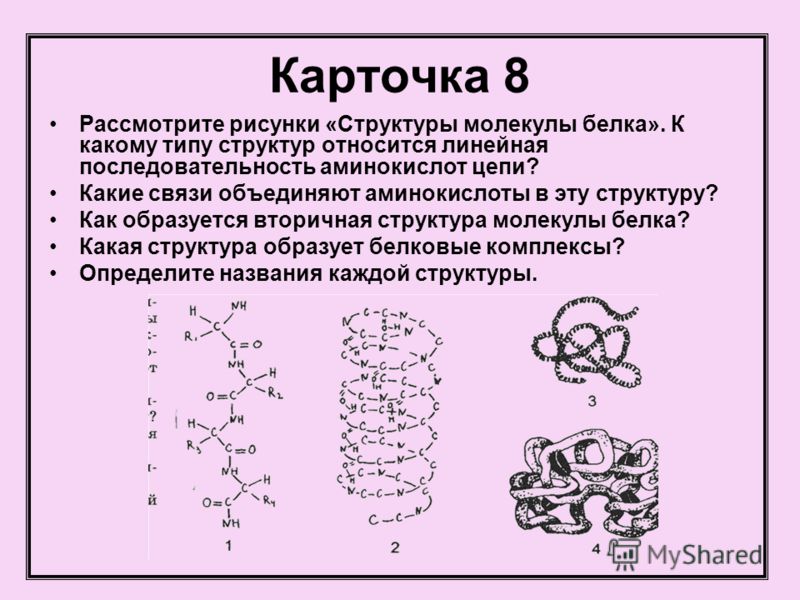 Например, инсулин регулирует уровень глюкозы в крови, а также увеличивает образование жиров из углеводов.
Например, инсулин регулирует уровень глюкозы в крови, а также увеличивает образование жиров из углеводов.
Защитная
При попадании в организм чужеродного белка или микроорганизма образуются особые белки — антитела. Защитой организма от чрезмерной кровопотери является превращение белка фибриногена. Конечно, в этом процессе участвуют и другие белки, например тромбин, а также множество других факторов свертывания. Защиту нашего желудка от воздействия сильнокислой среды обеспечивает белок муцин, основу кожи составляет коллаген, а кератин является белком защитного волосяного покрова.
Двигательная
Двигательную функцию обеспечивают специальные сократительные белки, например актин и миозин, которые участвуют в сокращении скелетных мышц.
Сигнальная
В поверхность мембраны клетки встроены рецепторы (молекулы белков), которые в ответ на воздействие внешней среды способны изменять свою структуру, передавая команды в клетку.
Запасающая
Белки способны образовывать запасные отложения — правда, в организме животных белки, как правило, не запасаются. Но на каждое правило всегда найдется исключение — это альбумин, который содержится в яйцах, и казеин молока. Благодаря белкам в организме могут откладываться, например, ионы железа, которые впоследствии образуют комплекс с белком ферритином.
Энергетическая
Белки могут распадаться в клетке до составляющих, то есть до аминокислот. Часть этих аминокислот подвергается расщеплению, в ходе которого высвобождается энергия. При расщеплении 1 грамма белка выделяется 17,6 кДж, или 4,2 ккал, энергии. Но в этой роли белки используются крайне редко.
Каталитическая
Белки, которые называются ферментами, способны ускорять биохимические реакции, происходящие в клетке, — в этом заключается каталитическая функция белков.
Питательная, или резервная
Эту функцию выполняют резервные белки, которые являются источником питания для плода. Такими белками могут быть казеин — белок молока, овальбумины — белки яйца, проламины и глютелины — белки растений.
Такими белками могут быть казеин — белок молока, овальбумины — белки яйца, проламины и глютелины — белки растений.
Функция антифриза
Антифризные белки способны понижать температуру замерзания раствора в клетках, чтобы предупредить замерзание в условиях низких температур.
Белки как класс органических соединений
А теперь рассмотрим белки с точки зрения химии. В состав белков живых организмов входит только 20 типов аминокислот. Все они являются альфа-аминокислотами, а состав белка и порядок соединения аминокислот друг с другом определяется индивидуальным генетическим кодом.
Перед нами пример альфа-аминокислоты, которая называется альфа-аминопропановой. В строении аминокислоты можно выделить две функциональные группы: карбоксильную (—СООН), которая отвечает за кислотные свойства, и аминогруппу (—NH2), которая, в свою очередь, отвечает за основные свойства.
Отсюда можно сделать вывод, что все аминокислоты являются амфотерными соединениями и способны реагировать друг с другом по разным функциональным группам с образованием пептидной связи:
Химические свойства белков очень ограниченны. Давайте их рассмотрим.
Гидролиз
Все белки способны вступать в реакцию гидролиза. В общем виде данная реакция выглядит следующим образом:
Белок + nH2O = смесь из α-аминокислот.
Денатурация
Денатурация — это разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры.
Напомним виды структур белка:
The image is a derivative of «Protein structure vector illustration» by VectorMine on Shutterstock.
Денатурация может быть обратимой, а может быть необратимой:
Как видно из условий, обратимость зависит от условий протекания реакций. Чем они жестче, тем меньше вероятность обратимости реакции.
Чем они жестче, тем меньше вероятность обратимости реакции.
Биуретовая реакция (качественная реакция на белок)
Раствор белка + NaOH(10%-й р-р) + CuSO4 = фиолетовое окрашивание.
Ксантопротеиновая реакция (качественная реакция на белок)
Растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
Раствор белка + HNO3 (конц) = желтое окрашивание.
Реакция Фоля (цистеиновая проба)
Эта реакция является качественной для аминокислот, содержащих серу:
Белок + (CH3COO)2Pb + NaOH = PbS + черное окрашивание.
Вопросы для самопроверки
Какая из структур белка является самой прочной?
Первичная
Вторичная
Третичная
Четвертичная
Какую из перечисленных функций способен выполнять белок?
Результативную
Регуляторную
Регулятивную
Растворную
За счет какой связи образуется первичная структура белка?
Ионной
Водородной
Пептидной
Ковалентной неполярной
При гидролизе белка получается (получаются).
 ..
..Аминокислоты, образующие этот белок
Углекислый газ
Аминокислота и вода
Белок гидролизу не подвергается
Какая реакция с белком дает фиолетовое окрашивание?
Ксантопротеиновая
Цистеиновая
Биуретовая
Денатурация
Еще больше наглядных примеров функций белков в клетках живых организмов — на онлайн-курсах химии в Skysmart. Мы поможем полюбить предмет, разобраться в непонятных темах, улучшить оценки в школе и подготовиться к государственным экзаменам. Выберите подходящий курс и начните учиться с удовольствием!
Мы поможем полюбить предмет, разобраться в непонятных темах, улучшить оценки в школе и подготовиться к государственным экзаменам. Выберите подходящий курс и начните учиться с удовольствием!
Ответы на вопросы
a
b
c
a
c
молочных белков-казеинов; казеиновые мицеллы; сывороточные протеины; Электронная книга «Ферменты – Молочная наука и технология»
Молочная химия и физика
Первичная структура белков состоит из полипептидной цепи аминокислотных остатков, соединенных вместе пептидными связями, которые также могут быть сшиты дисульфидными мостиками. Аминокислоты содержат как слабоосновную аминогруппу, так и слабокислотную карбоксильную группу, соединенные с углеводородной цепью, уникальной для разных аминокислот. Трехмерная организация белков, или конформация также включает вторичные, третичные и четвертичные структуры. Вторичная структура относится к пространственному расположению аминокислотных остатков, которые находятся рядом друг с другом в линейной последовательности. Альфа-спираль и ß-складчатая оболочка являются примерами вторичных структур, возникающих в результате регулярных и периодических стерических отношений. Третичная структура относится к пространственному расположению аминокислотных остатков, которые находятся далеко друг от друга в линейной последовательности, что приводит к дальнейшему скручиванию и складыванию. Если белок плотно свернут и имеет несколько сферическую форму, он называется глобулярный белок. Если белок состоит из длинных полипептидных цепей, связанных между собой межмолекулярными связями, их называют волокнистыми белками. Четвертичная структура возникает, когда белки с двумя или более субъединицами полипептидной цепи связаны.
Трехмерная организация белков, или конформация также включает вторичные, третичные и четвертичные структуры. Вторичная структура относится к пространственному расположению аминокислотных остатков, которые находятся рядом друг с другом в линейной последовательности. Альфа-спираль и ß-складчатая оболочка являются примерами вторичных структур, возникающих в результате регулярных и периодических стерических отношений. Третичная структура относится к пространственному расположению аминокислотных остатков, которые находятся далеко друг от друга в линейной последовательности, что приводит к дальнейшему скручиванию и складыванию. Если белок плотно свернут и имеет несколько сферическую форму, он называется глобулярный белок. Если белок состоит из длинных полипептидных цепей, связанных между собой межмолекулярными связями, их называют волокнистыми белками. Четвертичная структура возникает, когда белки с двумя или более субъединицами полипептидной цепи связаны.
Фракционирование молочного белка
Содержание азота в молоке распределяется между казеинами (75%), сывороточными белками (18%), разными белками (2%) и небелковым азотом (5%). Это распределение азота можно определить по Фракционирование по Роуленду метод:
- Осаждение при pH 4,6 – отделяет казеины от азота сыворотки
- Осаждение ацетатом натрия и уксусной кислотой (pH 5,0) – отделение общего белка от сыворотки NPN
Девяносто пять процентов азота связано с белком. Средняя концентрация белков в молоке следует (хотя могут быть значительные естественные колебания):
| грамм/литр | % общего белка | |
|---|---|---|
| Общий белок | 33,0 | 100 |
| Всего казеинов | 26,0 | 78,8 |
| альфа-s1-казеин | 10,7 | 32,4 |
| альфа-s2-казеин | 2,8 | 8,5 |
| бета-казеин | 8,6 | 26,1 |
| каппа-казеин | 3,1 | 9,4 |
| гамма-казеин | 0,8 | 2,4 |
| Всего сывороточных белков | 6,4 | 19,4 |
| альфа-лактальбумин | 1,2 | 3,6 |
| бета-лактоглобулин | 3,2 | 9,8 |
| БСА | 0,4 | 1,2 |
| Иммуноглобулины | 0,8 | 2,4 |
| Протеозопептон | 0,8 | 2,4 |
| Разное | 0,6 | 1,8 |
Казеины, а также их структурные формы – казеиновые мицеллы, сывороточные белки и молочные ферменты теперь будут рассмотрены более подробно.
Содержание казеина в молоке составляет около 80% белков молока. Основные фракции казеина: альфа(s1) и альфа(s2)-казеины, β-казеин и каппа-казеин . Отличительной чертой всех казеинов является их низкая растворимость при рН 4,6. Общим композиционным фактором является то, что казеины представляют собой конъюгированные белки , большинство из которых имеет фосфатную группу (группы), этерифицированную остатками серина. Эти фосфатные группы важны для структуры мицеллы казеина. Связывание кальция отдельными казеинами пропорционально содержанию фосфатов.
Конформация казеинов очень похожа на конформацию денатурированных глобулярных белков. остатков пролина в казеинах вызывает особое изгибание белковой цепи и ингибирует образование плотно упакованных, упорядоченных вторичных структур. Казеины не содержат дисульфидных связей. Кроме того, отсутствие третичной структуры объясняет устойчивость казеинов к тепловой денатурации, потому что очень мало структуры может раскрыться. Без третичной структуры происходит значительное обнажение гидрофобных остатков. Это приводит к сильным реакциям ассоциации казеинов и делает их нерастворимыми в воде.
Без третичной структуры происходит значительное обнажение гидрофобных остатков. Это приводит к сильным реакциям ассоциации казеинов и делает их нерастворимыми в воде.
Внутри группы казеинов существует несколько отличительных признаков, основанных на распределении их заряда и чувствительности к осаждению кальция:
альфа(s1)-казеин: (молекулярная масса 23 000; 199 остатков, 17 остатков пролина)
Две гидрофобные области , содержащий все остатки пролина, разделенные полярной областью, которая содержит все восемь фосфатных групп, кроме одной. Он может осаждаться при очень низком уровне кальция.
альфа(s2)-казеин: (молекулярная масса 25 000; 207 остатков, 10 пролинов)
Сконцентрированные отрицательные заряды вблизи N-конца и положительные заряды вблизи С-конца. Он также может осаждаться при очень низком уровне кальция.
ß-казеин: (молекулярная масса 24 000; 209 остатков, 35 пролинов)
Сильно заряженный N-концевой участок и гидрофобный С-концевой участок. Очень амфифильный белок действует как моющая молекула. Самоассоциация зависит от температуры; образует крупный полимер при 20°C, но не при 4°C. Менее чувствителен к осаждению кальция.
Очень амфифильный белок действует как моющая молекула. Самоассоциация зависит от температуры; образует крупный полимер при 20°C, но не при 4°C. Менее чувствителен к осаждению кальция.
каппа-казеин: (молекулярная масса 19 000; 169 остатков, 20 пролинов)
Очень устойчив к осаждению кальция, стабилизирует другие казеины. Расщепление сычужного фермента по связи Phe105-Met106 устраняет стабилизирующую способность, оставляя гидрофобную часть, пара-каппа-казеин, и гидрофильную часть, называемую гликомакропептидом каппа-казеина (GMP), или, точнее, казеинамакропептид (CMP).
Большинство, но не все, белков казеина существуют в виде коллоидных частиц, известных как казеиновая мицелла . Его биологическая функция заключается в переносе больших количеств малорастворимого СаР в детеныши млекопитающих в жидкой форме и в формировании сгустка в желудке для более эффективного питания. Помимо казеинового белка, кальция и фосфата, мицелла также содержит цитрат, минорные ионы, ферменты липазы и плазмина и захваченную молочную сыворотку. Эти мицеллы представляют собой достаточно пористые структуры, занимающие около 4 мл/г и 6-12% от общей объемной доли молока. Размер колеблется от 50-250 нм в диаметре.
Эти мицеллы представляют собой достаточно пористые структуры, занимающие около 4 мл/г и 6-12% от общей объемной доли молока. Размер колеблется от 50-250 нм в диаметре.
Изображение мицеллы казеина от Dalgleish, D.G., P. Spagnuolo and H.D. Goff. 2004. Возможная структура мицеллы казеина по данным автоэмиссионной сканирующей электронной микроскопии высокого разрешения. Международный молочный журнал. 14: 1025-1031. Эта мицелла имеет диаметр 120 нм.
За прошедшие годы было разработано множество моделей для объяснения структуры мицеллы казеина на основе всей доступной информации о ее составе и реакционной способности. Казеиновая субмицеллярная модель использовалась в течение многих лет, но в настоящее время имеется достаточно доказательств, чтобы сделать вывод о том, что у мицеллы вообще нет определенной субмицеллярной структуры. Более поздние модели предполагают более открытую структуру, состоящую из агрегатов белка вокруг нанокластеров фосфата кальция. Каждый из казеиновых белков обладает уникальной способностью связываться либо с CaP, либо с другими казеинами, которые могут образовывать агрегаты. Нанокластеры обеспечивают области большей или меньшей плотности. Структура достаточно пористая, чтобы удерживать значительное количество воды, а поверхность и даже часть внутренней части вступать в реакцию с другими веществами. Все модели согласны с тем, что k-казеин в основном присутствует в виде стабилизирующего слоя вокруг внешней поверхности мицеллы. Подробную информацию о структурах и моделях мицелл см. в любой из следующих ссылок.
Нанокластеры обеспечивают области большей или меньшей плотности. Структура достаточно пористая, чтобы удерживать значительное количество воды, а поверхность и даже часть внутренней части вступать в реакцию с другими веществами. Все модели согласны с тем, что k-казеин в основном присутствует в виде стабилизирующего слоя вокруг внешней поверхности мицеллы. Подробную информацию о структурах и моделях мицелл см. в любой из следующих ссылок.
Коллоидный фосфат кальция (ККК) действует как цемент между сотнями или даже тысячами субмицелл, образующих мицеллу казеина. Связывание может быть ковалентным или электростатическим. Субмицеллы, богатые каппа-казеином, занимают поверхностное положение, тогда как субмицеллы с меньшим содержанием погребены внутри. Образовавшийся волосатый слой толщиной не менее 7 нм предотвращает дальнейшую агрегацию субмицелл за счет стерического отталкивания . Мицеллы казеина не статичны; между мицеллой и ее окружением существует три динамических равновесия:
- свободные молекулы казеина и субмицеллы
- свободные субмицеллы и мицеллы
- растворенный коллоидный кальций и фосфат
При оценке стабильности мицеллы казеина необходимо учитывать следующие факторы:
Роль Ca++:
Более 90% содержания кальция в обезжиренном молоке так или иначе связано с мицеллой казеина. Удаление Ca++ приводит к обратимой диссоциации ß-казеина без распада мицеллюлярной ткани. Добавление Са++ приводит к агрегации.
Удаление Ca++ приводит к обратимой диссоциации ß-казеина без распада мицеллюлярной ткани. Добавление Са++ приводит к агрегации.
H Связывание:
Некоторое количество происходит между отдельными казеинами в мицелле, но незначительно, поскольку в казеиновых белках отсутствует вторичная структура.
Дисульфидные связи:
альфа(s1) и ß-казеины не содержат остатков цистеина. Если внутри мицеллы возникают какие-либо связи S-S, они не являются движущей силой стабилизации.
Гидрофобные взаимодействия:
Казеины относятся к наиболее гидрофобным белкам, и есть некоторые свидетельства того, что они играют роль в стабильности мицеллы. Следует помнить, что гидрофобные взаимодействия очень чувствительны к температуре.
Электростатические взаимодействия:
Некоторые взаимодействия субъединиц могут быть результатом ионной связи, но в целом мицеллярная структура очень рыхлая и открытая.
Силы Ван-дер-Ваальса:
Не удалось связать эти силы со стабильностью мицелл.
Стерическая стабилизация:
Как уже отмечалось, волосатый слой препятствует сближению частиц.
На стабильность мицеллярной системы казеина влияет несколько факторов:
Содержание соли:
влияет на активность кальция в сыворотке и содержание фосфата кальция в мицеллах.
pH:
снижение pH приводит к растворению фосфата кальция до тех пор, пока в изоэлектрической точке (pH 4,6) весь фосфат не растворится и казеины не осядут.
Температура:
при 4°С бета-казеин начинает диссоциировать от мицеллы, при 0°С мицеллярная агрегация отсутствует; при замораживании образуется осадок, называемый криоказеином.
Тепловая обработка:
сывороточные белки адсорбируются, изменяя поведение мицеллы.
Дегидратация:
этанолом, например, приводит к агрегации мицелл.
Когда два или более из этих факторов применяются вместе, эффект также может быть аддитивным.
Хотя казеиновая мицелла довольно стабильна, существует четыре основных способа вызвать агрегацию:
1. Ферментативный – химозин (сычужный фермент) или другие протеолитические ферменты, как при производстве сыра.
Ферментативный – химозин (сычужный фермент) или другие протеолитические ферменты, как при производстве сыра.
Химозин или сычужный фермент чаще всего используется для ферментативной коагуляции. На первичной стадии сычужный фермент расщепляет связь Phe(105)-Met(106) каппа-казеина, что приводит к образованию растворимого CMP, который диффундирует от мицеллы и пара-каппа-казеина, отчетливо гидрофобного пептида, который остается на мицелле. Пластырь или реактивный сайт, как показано на изображении ниже, который остается на мицеллах после ферментативного расщепления, необходим, прежде чем может начаться агрегация мицелл параказеина.
Во время вторичной стадии мицеллы объединяются, как показано справа внизу. Это связано с потерей стерического отталкивания каппа-казеина, а также с потерей электростатического отталкивания из-за снижения рН. Когда рН приближается к своей изоэлектрической точке (рН 4,6), казеины агрегируют.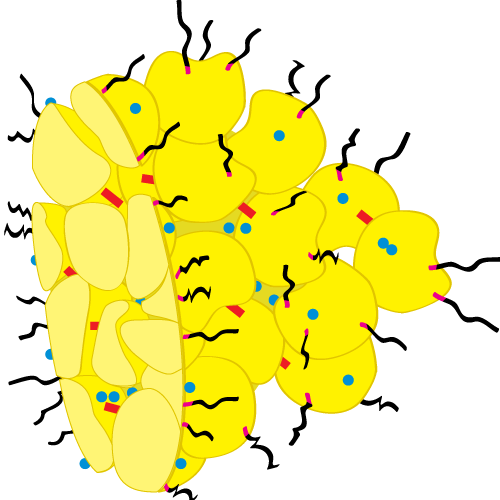 Мицеллы казеина также имеют сильную тенденцию к агрегации из-за гидрофобных взаимодействий. Кальций способствует коагуляции, создавая изоэлектрические условия и действуя как мостик между мицеллами. Температура во время коагуляции очень важна как для первичной, так и для вторичной стадии. При повышении температуры до 40°С скорость сычужной реакции увеличивается. Во время вторичной стадии повышенные температуры усиливают гидрофобную реакцию. третичная стадия коагуляции включает перегруппировку мицелл после образования геля. По мере уплотнения молочного творога и начала синерезиса происходит потеря идентичности параказеина.
Мицеллы казеина также имеют сильную тенденцию к агрегации из-за гидрофобных взаимодействий. Кальций способствует коагуляции, создавая изоэлектрические условия и действуя как мостик между мицеллами. Температура во время коагуляции очень важна как для первичной, так и для вторичной стадии. При повышении температуры до 40°С скорость сычужной реакции увеличивается. Во время вторичной стадии повышенные температуры усиливают гидрофобную реакцию. третичная стадия коагуляции включает перегруппировку мицелл после образования геля. По мере уплотнения молочного творога и начала синерезиса происходит потеря идентичности параказеина.
Модель Шмидта
2. Кислота . Подкисление вызывает дестабилизацию или агрегацию мицелл казеина за счет уменьшения их электрического заряда до уровня изоэлектрической точки. В то же время кислотность среды увеличивает растворимость минералов, так что содержащиеся в мицелле органические кальций и фосфор постепенно становятся растворимыми в водной фазе. Мицеллы казеина распадаются, и казеин выпадает в осадок. Агрегация происходит в результате энтропийных гидрофобных взаимодействий.
Мицеллы казеина распадаются, и казеин выпадает в осадок. Агрегация происходит в результате энтропийных гидрофобных взаимодействий.
3. Нагрев . Молоко, как правило, очень стабильно нагревается до 90-95°C. При температурах выше точки кипения мицеллы казеина необратимо агрегируют. При нагревании изменяется буферная емкость солей молока, выделяется углекислый газ, образуются органические кислоты, могут осаждаться трикальцийфосфат и казеинфосфат с выделением ионов водорода.
4. Старение гелеобразователя . Гелеобразование при старении — это явление агрегации, которое влияет на стерилизованные молочные продукты длительного хранения, такие как концентрированное молоко и ультрапастеризованные молочные продукты. После хранения этих продуктов от недель до месяцев происходит внезапное резкое увеличение вязкости, сопровождающееся видимым гелеобразованием и необратимой агрегацией мицелл в длинные цепи, образующие трехмерную сеть. Фактическая причина и механизм еще не ясны, однако существуют некоторые теории:
- Протеолитическое расщепление казеина: ферменты бактериального или нативного плазмина, устойчивые к термической обработке, могут привести к образованию медленного образования геля в течение длительного периода времени.

- Химические реакции: полимеризация казеина и белков молочной сыворотки по типу Майяра или другие химические реакции
- Образование комплексов каппа-казеин-ß-лактоглобулин
Отличный источник информации о стабильности мицелл казеина можно найти в Walstra et al., 2006.
Белки, появляющиеся в надосадочной жидкости молока после осаждения при pH 4,6, в совокупности называются сывороточными белками. Эти глобулярные белки более растворимы в воде, чем казеины, и подвержены тепловой денатурации. Нативные сывороточные белки обладают хорошими желирующими и взбивающими свойствами. Денатурация увеличивает их водоудерживающую способность. Основными фракциями являются ß-лактоглобулин, альфа-лактальбумин, бычий сывороточный альбумин (БСА) и иммуноглобулины (Ig).
ß-лактоглобулины : (молекулярная масса – 18 000; 162 остатка) Эта группа, включающая восемь генетических вариантов, включает примерно половину всех белков молочной сыворотки. ß-лактоглобулин имеет две внутренние дисульфидные связи и одну свободную тиоловую группу. Конформация включает значительную вторичную структуру и существует в природе в виде нековалентно связанного димера. В изоэлектрической точке (pH от 3,5 до 5,2) димеры далее связываются с октамерами, но при pH ниже 3,4 диссоциируют до мономеров.
ß-лактоглобулин имеет две внутренние дисульфидные связи и одну свободную тиоловую группу. Конформация включает значительную вторичную структуру и существует в природе в виде нековалентно связанного димера. В изоэлектрической точке (pH от 3,5 до 5,2) димеры далее связываются с октамерами, но при pH ниже 3,4 диссоциируют до мономеров.
альфа-лактальбумины : (молекулярная масса – 14 000; 123 остатка) Эти белки содержат восемь цистеиновых групп, все из которых вовлечены во внутренние дисульфидные связи, и четыре остатка триптофана. Альфа-лактальбумин имеет высокоупорядоченную вторичную структуру и компактную сферическую третичную структуру. Термическая денатурация и pH <4,0 приводят к высвобождению связанного кальция.
Ферменты представляют собой группу белков, обладающих способностью катализировать химические реакции и скоростью таких реакций. Действие ферментов весьма специфично. Молоко содержит оба местные и экзогенные ферменты. Экзогенные ферменты в основном состоят из термостабильных ферментов, продуцируемых психротрофными бактериями: липазы и протеиназы. Есть много местных ферментов, которые были выделены из молока. Наиболее значительную группу составляют гидролазы:
Экзогенные ферменты в основном состоят из термостабильных ферментов, продуцируемых психротрофными бактериями: липазы и протеиназы. Есть много местных ферментов, которые были выделены из молока. Наиболее значительную группу составляют гидролазы:
- липопротеинлипаза
- плазмин
- щелочная фосфатаза
Липопротеинлипаза (LPL) : Фермент липаза расщепляет жиры на глицерин и свободные жирные кислоты. Этот фермент находится в основном в плазме в ассоциации с мицеллами казеина. Молочный жир защищен от его действия FGM. Если FGM поврежден или присутствуют определенные кофакторы (липопротеины сыворотки крови), LPL может атаковать липопротеины FGM. Таким образом может быть вызван липолиз.
Плазмин : Плазмин представляет собой протеолитический фермент; он расщепляет белки. Плазмин атакует как ß-казеин, так и альфа(s2)-казеин. Он очень термостабилен и ответственен за развитие горечи в пастеризованном молоке и молоке, прошедшем ультрапастеризацию.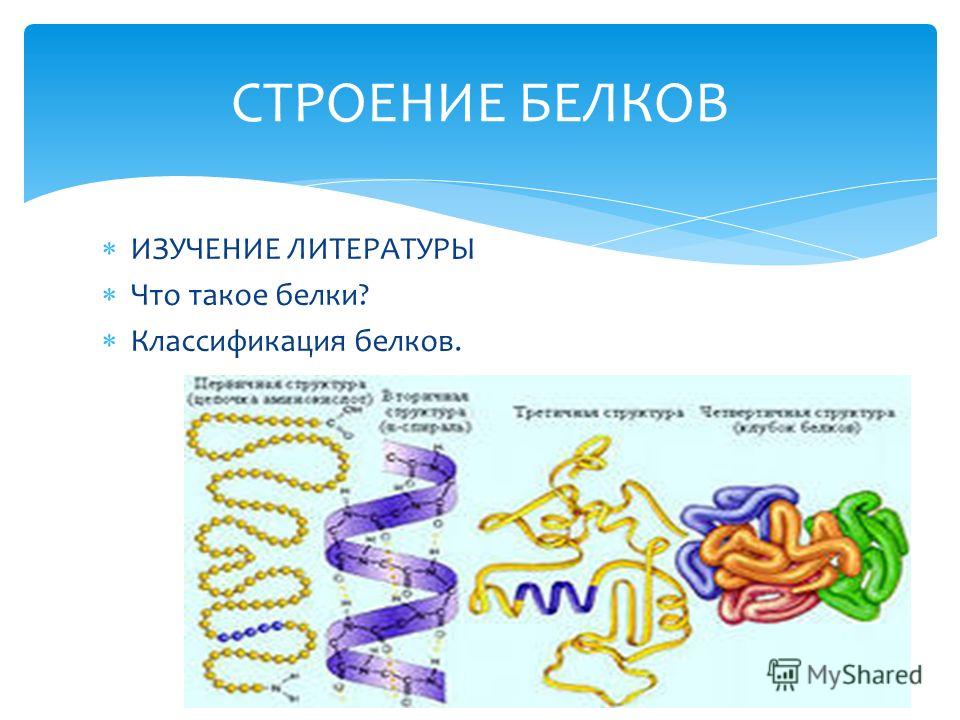 Он также может играть роль в созревании и развитии вкуса некоторых сыров, таких как швейцарский сыр.
Он также может играть роль в созревании и развитии вкуса некоторых сыров, таких как швейцарский сыр.
Щелочная фосфатаза : Ферменты фосфатазы способны расщеплять определенные эфиры фосфорной кислоты на фосфорную кислоту и родственные спирты. В отличие от большинства молочных ферментов, он имеет оптимумы рН и температуры, отличные от физиологических значений; рН 9.8. Фермент разрушается при минимальных температурах пастеризации, поэтому для обеспечения правильной пастеризации можно провести тест на фосфатазу.
Белки грудного молока: состав и физиологическое значение
Белки грудного молока: состав и физиологическое значение
Шарон М. Донован
Грудное молоко (ГМ) — идеальная пища, обеспечивающая оптимальный рост и развитие младенцев [1]. Кроме того, ТМ содержит широкий спектр биоактивных компонентов, включая липиды, олигосахариды и белки. За последние 30 лет детские смеси претерпели кардинальные изменения в питательном составе, чтобы более точно имитировать состав ГМ [2]. Тем не менее, клинические и эпидемиологические исследования показывают, что различия в краткосрочных и долгосрочных результатах для здоровья все еще сохраняются между младенцами на грудном вскармливании и на искусственном вскармливании, включая характер роста, состояние питания, состав микробиоты кишечника, распространенность инфекции и результаты для здоровья [1]. ГМ содержит более 400 белков, которые можно условно разделить на 3 категории: казеины, сывороточные белки и муцины, присутствующие в мембране шариков молочного жира (MFGM). ТМ преобладает в сыворотке, но соотношение сыворотка/казеин у ТМ меняется в течение лактации и составляет 9.0/10 в молозиве и меняется на 60/40 в зрелых ГМ. В ГМ преобладают казеины b и k, тогда как в коровьем молоке содержатся казеины a, b, g и k. Белки, присутствующие в значительных количествах в сывороточной фракции, представляют собой а-лактальбумин, лактоферрин, IgA, остеопонтин (ОПН) и лизоцим. Преобладающим сывороточным белком в коровьем молоке является β-лактоглобулин, хотя низкие концентрации α-лактальбумина, лактоферрина и OPN в коровьем молоке позволили выделить и использовать их в доклинических и клинических испытаниях.
Тем не менее, клинические и эпидемиологические исследования показывают, что различия в краткосрочных и долгосрочных результатах для здоровья все еще сохраняются между младенцами на грудном вскармливании и на искусственном вскармливании, включая характер роста, состояние питания, состав микробиоты кишечника, распространенность инфекции и результаты для здоровья [1]. ГМ содержит более 400 белков, которые можно условно разделить на 3 категории: казеины, сывороточные белки и муцины, присутствующие в мембране шариков молочного жира (MFGM). ТМ преобладает в сыворотке, но соотношение сыворотка/казеин у ТМ меняется в течение лактации и составляет 9.0/10 в молозиве и меняется на 60/40 в зрелых ГМ. В ГМ преобладают казеины b и k, тогда как в коровьем молоке содержатся казеины a, b, g и k. Белки, присутствующие в значительных количествах в сывороточной фракции, представляют собой а-лактальбумин, лактоферрин, IgA, остеопонтин (ОПН) и лизоцим. Преобладающим сывороточным белком в коровьем молоке является β-лактоглобулин, хотя низкие концентрации α-лактальбумина, лактоферрина и OPN в коровьем молоке позволили выделить и использовать их в доклинических и клинических испытаниях. Кроме того, биоактивные пептиды образуются при переваривании казеина и сыворотки, а гликаны из гликопротеинов являются бифидогенными, что еще больше усложняет функциональные свойства белков ТМ. Эти функции включают в себя: служение в качестве источника аминокислот; повышение биодоступности микронутриентов, в том числе витаминов, минералов и микроэлементов, обеспечивающих стимуляцию роста и созревания кишечника; поддержка иммунологической защиты; формирование микробиома; улучшение обучения и памяти (рис. 1) [2, 3]. Недавние достижения в области молочных технологий позволили выделить биологически активные молочные белки из коровьего молока в количествах, достаточных для клинических исследований и, в некоторых случаях, для добавления в коммерчески доступные детские смеси [2].
Кроме того, биоактивные пептиды образуются при переваривании казеина и сыворотки, а гликаны из гликопротеинов являются бифидогенными, что еще больше усложняет функциональные свойства белков ТМ. Эти функции включают в себя: служение в качестве источника аминокислот; повышение биодоступности микронутриентов, в том числе витаминов, минералов и микроэлементов, обеспечивающих стимуляцию роста и созревания кишечника; поддержка иммунологической защиты; формирование микробиома; улучшение обучения и памяти (рис. 1) [2, 3]. Недавние достижения в области молочных технологий позволили выделить биологически активные молочные белки из коровьего молока в количествах, достаточных для клинических исследований и, в некоторых случаях, для добавления в коммерчески доступные детские смеси [2].
Рис. 1. Биологические функции белков грудного молока.
Здесь будут рассмотрены текущие данные о составе белков ТМ и биологической активности белков ТМ с акцентом на лактоферрин, ОПН и MFGM [4]. Лактоферрин представляет собой негемовый железосвязывающий белок, который, как было показано, благотворно влияет на всасывание железа у младенцев, находящихся на грудном вскармливании, и оказывает бактериостатическое действие. В модели поросят бычий лактоферрин стимулировал пролиферацию клеток кишечника. В рандомизированных контролируемых клинических исследованиях бычий лактоферрин уменьшал диарею и респираторные заболевания у доношенных детей, а также сепсис и некротизирующий энтероколит у недоношенных детей [5]. OPN представляет собой кислый, гликозилированный и высокофосфорилированный белок. Он взаимодействует с интегринами клеточной поверхности и рецептором CD44, влияя на биоминерализацию, ремоделирование тканей и иммунную регуляцию. Бычий OPN, добавленный в смесь в концентрации, присутствующей в HM, изменил экспрессию кишечных генов у макак-резусов, чтобы они стали более похожими на обезьян, находящихся на грудном вскармливании. В рандомизированном контролируемом клиническом исследовании ОПН крупного рогатого скота снижал частоту возникновения лихорадки и концентрацию ФНО-α в сыворотке [4].
Лактоферрин представляет собой негемовый железосвязывающий белок, который, как было показано, благотворно влияет на всасывание железа у младенцев, находящихся на грудном вскармливании, и оказывает бактериостатическое действие. В модели поросят бычий лактоферрин стимулировал пролиферацию клеток кишечника. В рандомизированных контролируемых клинических исследованиях бычий лактоферрин уменьшал диарею и респираторные заболевания у доношенных детей, а также сепсис и некротизирующий энтероколит у недоношенных детей [5]. OPN представляет собой кислый, гликозилированный и высокофосфорилированный белок. Он взаимодействует с интегринами клеточной поверхности и рецептором CD44, влияя на биоминерализацию, ремоделирование тканей и иммунную регуляцию. Бычий OPN, добавленный в смесь в концентрации, присутствующей в HM, изменил экспрессию кишечных генов у макак-резусов, чтобы они стали более похожими на обезьян, находящихся на грудном вскармливании. В рандомизированном контролируемом клиническом исследовании ОПН крупного рогатого скота снижал частоту возникновения лихорадки и концентрацию ФНО-α в сыворотке [4]. Наконец, MFGM представляет собой тройную мембранную систему, инкапсулирующую молочный жир. Он содержит клеточные компоненты, включая холестерин, глицеринфосфолипиды, сфинголипиды и белки, включая муцин 1, бутирофилин, CD36, адипофилин и лактадгерин. Эти биологически активные компоненты способствуют противовирусной и антибактериальной активности MGFM. В рандомизированных контролируемых клинических испытаниях MFGM из коровьего молока уменьшал диарею, лихорадку и использование жаропонижающих средств и повышал IQ [4]. Таким образом, ГМ содержит множество биоактивных белков, которые действуют независимо и синергетически, обеспечивая многоуровневую защиту от инфекции, а также стимулируя кишечное и когнитивное развитие и формируя микробиом. Очистка биологически активных белков из коровьего молока позволила провести клинические испытания на младенцах и, в конечном итоге, позволит модифицировать состав детских смесей, чтобы сузить различия в показателях здоровья между младенцами на грудном вскармливании и на искусственном вскармливании.
Наконец, MFGM представляет собой тройную мембранную систему, инкапсулирующую молочный жир. Он содержит клеточные компоненты, включая холестерин, глицеринфосфолипиды, сфинголипиды и белки, включая муцин 1, бутирофилин, CD36, адипофилин и лактадгерин. Эти биологически активные компоненты способствуют противовирусной и антибактериальной активности MGFM. В рандомизированных контролируемых клинических испытаниях MFGM из коровьего молока уменьшал диарею, лихорадку и использование жаропонижающих средств и повышал IQ [4]. Таким образом, ГМ содержит множество биоактивных белков, которые действуют независимо и синергетически, обеспечивая многоуровневую защиту от инфекции, а также стимулируя кишечное и когнитивное развитие и формируя микробиом. Очистка биологически активных белков из коровьего молока позволила провести клинические испытания на младенцах и, в конечном итоге, позволит модифицировать состав детских смесей, чтобы сузить различия в показателях здоровья между младенцами на грудном вскармливании и на искусственном вскармливании.
Ссылки
- Виктора К.Г., Бахл Р., Баррос А.Дж. и др.: Грудное вскармливание в 21 веке: эпидемиология, механизмы и пожизненный эффект. Ланцет 2016; 387: 475–490.
- Hernell O: Грудное молоко в сравнении с коровьим молоком и эволюция детских смесей. Nestlé Nutr Workshop Ser Pediatr Program 2011;67:17–28.
- Лённердал Б., Эрдманн П., Таккар С.К. и др.: Продольная эволюция истинного белка, аминокислот и биологически активных белков в грудном молоке: перспектива развития. J Nutr Biochem 2017;41:1–11.
- Demmelmair H, Prell C, Timby N, et al: Преимущества лактоферрина, остеопонтина и мембран глобул молочного жира для младенцев. Питательные вещества 2017;9:E817. 5 Донован С.М.: Роль лактоферрина в развитии и функционировании желудочно-кишечного тракта и иммунитета: доклиническая перспектива. J Pediatr 2016; 173S:S16–S28.
- Донован С.М.: Роль лактоферрина в развитии и функционировании желудочно-кишечного тракта и иммунитета: доклиническая перспектива.
 J Pediatr 2016; 173S:S16–S28.
J Pediatr 2016; 173S:S16–S28.
Аннотация
Грудное молоко (ГМ) содержит сотни белков с очень разнообразными функциями, которые, вероятно, способствуют краткосрочным и долгосрочным положительным эффектам грудного вскармливания. Эти функции включают в себя использование в качестве источника аминокислот, повышение биодоступности питательных микроэлементов, включая витамины, минералы и микроэлементы, обеспечение иммунологической защиты, стимуляцию роста и созревания кишечника, формирование микробиома и улучшение обучения и памяти. Белки грудного молока можно условно разделить на 3 категории: казеины, сывороточные белки и муцины, которые присутствуют в мембране шариков молочного жира. ГМ преобладает в сыворотке; однако соотношение сыворотка/казеин у ТМ изменяется с 9от 0/10 в молозиве до 60/40 в зрелых ГМ. Сывороточные белки, присутствующие в значительных количествах в сывороточной фракции, представляют собой α-лактальбумин, лактоферрин, IgA, остеопонтин и лизоцим. Кроме того, биоактивные пептиды образуются при переваривании казеина и сыворотки, а гликаны из гликопротеинов являются бифидогенными, что еще больше усложняет функциональные свойства белков ТМ. Недавние достижения в области молочных технологий позволили выделить биологически активные молочные белки из коровьего молока в количествах, достаточных для клинических исследований и, в некоторых случаях, для добавления в коммерчески доступные смеси для детского питания. В настоящем документе рассматриваются современные данные о составе белков ТМ и биологической активности белков ТМ.
Недавние достижения в области молочных технологий позволили выделить биологически активные молочные белки из коровьего молока в количествах, достаточных для клинических исследований и, в некоторых случаях, для добавления в коммерчески доступные смеси для детского питания. В настоящем документе рассматриваются современные данные о составе белков ТМ и биологической активности белков ТМ.
Введение
Грудное молоко (ГМ) содержит питательные вещества в легко биодоступных формах, которые обеспечивают оптимальный рост и развитие младенцев [1]. ТМ также содержит множество биологически активных белков, липидов и олигосахаридов, которые выполняют непищевую роль [2]. За последние 30 лет состав детских смесей эволюционировал, чтобы более точно имитировать состав ГМ [3]. Однако, несмотря на эти попытки, различия в росте [4], развитии нервной системы [5], составе микробиома [6], иммунной функции [7] и заболеваемости инфекционными заболеваниями [8] сохраняются между детьми, находящимися на грудном и искусственном вскармливании. Считается, что биологически активные компоненты ГМ частично ответственны за эти различия в развитии. Здесь будут рассмотрены белки HM, которые обеспечивают незаменимые аминокислоты для роста, а также биоактивные белки и пептиды, которые выполняют непищевую роль в развитии новорожденного [9].].
Считается, что биологически активные компоненты ГМ частично ответственны за эти различия в развитии. Здесь будут рассмотрены белки HM, которые обеспечивают незаменимые аминокислоты для роста, а также биоактивные белки и пептиды, которые выполняют непищевую роль в развитии новорожденного [9].].
Рис. 1. Сравнение соотношения сыворотка/казеин в зрелом грудном молоке, коровьем молоке и стандартных коммерческих смесях для детского питания.
Состав белков грудного молока
Приблизительно 400 белков ТМ [10, 11] подразделяются на 3 категории: казеины, сывороточные белки и муцины, последние из которых присутствуют в мембране шариков молочного жира (MFGM) [12 ]. В коровьем молоке преобладает казеин, тогда как в ГМ преобладает сыворотка. Соотношение сыворотка ТМ/казеин меняется в течение лактации, снижаясь с 90/10 в молозиве (дни [д] 0–5) до 65/35 в переходном молоке (д6–15), затем 60/40 через 1 месяц после родов и в течение первого года лактации [12]. Коровье молоко содержит α-, β-, γ- и κ-казеины, тогда как ГМ содержит β- и κ-казеин с более низким содержанием α-казеина (рис. 1). Соотношение сыворотка/казеин в смеси аналогично зрелым ТМ (60/40), но смесь содержит все казеины из коровьего молока (рис. 1). Концентрации общего и β- и κ-казеина немного повышаются между ранним и переходным молоком, а затем снижаются и остаются относительно стабильными в зрелом молоке. Напротив, концентрация α-казеина постоянна на протяжении всей лактации (табл. 1) [13].
Коровье молоко содержит α-, β-, γ- и κ-казеины, тогда как ГМ содержит β- и κ-казеин с более низким содержанием α-казеина (рис. 1). Соотношение сыворотка/казеин в смеси аналогично зрелым ТМ (60/40), но смесь содержит все казеины из коровьего молока (рис. 1). Концентрации общего и β- и κ-казеина немного повышаются между ранним и переходным молоком, а затем снижаются и остаются относительно стабильными в зрелом молоке. Напротив, концентрация α-казеина постоянна на протяжении всей лактации (табл. 1) [13].
Сывороточные белки HM, присутствующие в самой высокой концентрации, представляют собой α-лактальбумин, лактоферрин (LF), секреторный IgA, остеопонтин (OPN) и лизоцим (таблица 2) [9, 11, 14]. В целом концентрации этих белков резко снижаются от молозива к зрелым ТМ, за исключением лизоцима, содержание которого остается относительно стабильным [9]. Протеомный анализ сыворотки HM выявил 115 уникальных белков, из которых 35% были связаны с иммунным ответом [15]. Другими ключевыми функциями были клеточная коммуникация (17% белков), метаболизм/выработка энергии (16%) и общий транспорт (12%) [15].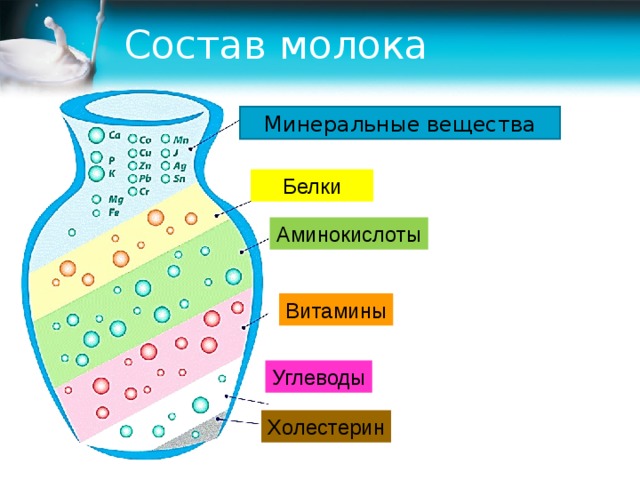 Протеомный анализ MFGM выявил 191, с функциями, обогащенными метаболизмом / производством энергии (21%), клеточной связью (19%) и общим транспортом (16%), и в меньшей степени иммунным ответом (20%) по сравнению с белками молочной сыворотки [15, 16]. ]. В этой статье было идентифицировано много новых белков MFGM и дано представление о потенциальном значении MFGM для детского питания [16]. Преобладающим сывороточным белком в коровьем молоке является β-лактоглобулин, которого нет в ГМ. Коровье молоко также содержит меньше α-лактальбумина, ЛФ и ОПН, чем ТМ, при этом концентрации ЛФ и ОПН составляют 5 и 13% от концентрации ТМ соответственно [3, 17, 18]. Достижения в области молочных технологий позволили выделить биологически активные молочные белки из коровьего молока в количествах, достаточных для клинических исследований и, в некоторых случаях, для добавления в детские смеси [3, 19].].
Протеомный анализ MFGM выявил 191, с функциями, обогащенными метаболизмом / производством энергии (21%), клеточной связью (19%) и общим транспортом (16%), и в меньшей степени иммунным ответом (20%) по сравнению с белками молочной сыворотки [15, 16]. ]. В этой статье было идентифицировано много новых белков MFGM и дано представление о потенциальном значении MFGM для детского питания [16]. Преобладающим сывороточным белком в коровьем молоке является β-лактоглобулин, которого нет в ГМ. Коровье молоко также содержит меньше α-лактальбумина, ЛФ и ОПН, чем ТМ, при этом концентрации ЛФ и ОПН составляют 5 и 13% от концентрации ТМ соответственно [3, 17, 18]. Достижения в области молочных технологий позволили выделить биологически активные молочные белки из коровьего молока в количествах, достаточных для клинических исследований и, в некоторых случаях, для добавления в детские смеси [3, 19].].
Таблица 1. Концентрации (г/л) общего казеина и субъединиц казеина в грудном молоке в первый год лактации
Таблица 2. белок и основные белки молочной сыворотки в грудном молоке в первый год лактации
белок и основные белки молочной сыворотки в грудном молоке в первый год лактации
Рис. 2. Биологические функции белков грудного молока.
Биологическая активность белков ТМ
Белки ТМ выполняют ряд функций, в том числе: служат источником аминокислот; улучшение биодоступности питательных микроэлементов; стимулирование роста и созревания кишечника; поддержка иммунологической защиты; формирование микробиома; и улучшение обучения и памяти (рис. 2). Некоторые белки HM проявляют активность в нескольких категориях (таблица 3). Например, LF участвует в качестве переносчика питательных веществ, в защите хозяина и в стимулировании кишечных, когнитивных и иммунных функций [18, 20–22] (таблица 3). Кроме того, биоактивные пептиды образуются во время переваривания казеина и белков молочной сыворотки [12], а гликаны, высвобождаемые из гликопротеинов ТМ микробными гликозидазами, являются бифидогенными [23], что еще больше усложняет функциональные свойства белков ТМ. Из-за их многофункциональной роли 3 биоактивных белка, LF, OPN и MFGM, были выделены из коровьего молока и проверены на биологическую активность в доклинических исследованиях и клинических испытаниях на людях [18].
Из-за их многофункциональной роли 3 биоактивных белка, LF, OPN и MFGM, были выделены из коровьего молока и проверены на биологическую активность в доклинических исследованиях и клинических испытаниях на людях [18].
Таблица 3. Белки грудного молока, связанные с биологической функцией
Биоактивность лактоферрина
LF – негемовый железосвязывающий белок, один из наиболее широко изученных белков ТМ [20]. Рандомизированные контролируемые клинические испытания (РКИ) подтвердили антимикробную и иммуномодулирующую активность ЛФ. Например, кормление 1,0 г/день бычьего LF в течение 9 месяцев уменьшило колонизацию Giardia lamblia и увеличило рост младенцев в возрасте от 12 до 36 месяцев в Перу [24]. Добавление рекомбинантного ЛФ человека (1,0 г/л) и лизоцима (0,2 г/л) к раствору для пероральной регидратации уменьшало продолжительность диареи у перуанских младенцев в возрасте от 5 до 35 месяцев, госпитализированных по поводу диареи [25]. Кокрановский обзор пришел к выводу, что «доказательства среднего или низкого качества свидетельствуют о том, что пероральная профилактика ЛФ с пробиотиками или без них уменьшает поздний сепсис и некротизирующий энтероколит стадии II или выше у недоношенных детей без побочных эффектов» [26]. Таким образом, диетический LF эффективен как для профилактики, так и для лечения инфекционных заболеваний.
Кокрановский обзор пришел к выводу, что «доказательства среднего или низкого качества свидетельствуют о том, что пероральная профилактика ЛФ с пробиотиками или без них уменьшает поздний сепсис и некротизирующий энтероколит стадии II или выше у недоношенных детей без побочных эффектов» [26]. Таким образом, диетический LF эффективен как для профилактики, так и для лечения инфекционных заболеваний.
При пероральном введении ЛФ проявляет антибактериальную и противовирусную активность в кишечнике за счет прямого воздействия на патогены и воздействия на желудочно-кишечный тракт и иммунную функцию [20, 21]. Последние функции опосредованы тем, что LF поглощается клетками через рецептор-опосредованные пути и влияет на транскрипцию генов [27]. У поросят диетический бычий LF (1,0 или 3,6 г/л) увеличивал пролиферацию кишечных клеток, глубину крипт и экспрессию β-катенина в три раза [обзор в 21]. Кроме того, у поросят диетический бычий LF модулировал как системное, так и кишечное иммунное развитие, стимулируя сбалансированный ответ цитокинов Т-хелперов-1/Т-хелперов-2. Кроме того, иммунные клетки поросят, которых кормили LF, секретировали больше противовоспалительных цитокинов в нестимулированном состоянии, в то же время были подготовлены к более сильному провоспалительному ответу при воздействии бактериального триггера ex vivo [рассмотрено в 21].
Кроме того, иммунные клетки поросят, которых кормили LF, секретировали больше противовоспалительных цитокинов в нестимулированном состоянии, в то же время были подготовлены к более сильному провоспалительному ответу при воздействии бактериального триггера ex vivo [рассмотрено в 21].
С точки зрения когнитивного развития, поросята, которых кормили бычьим LF (0,6 г/л) с 3-го по 38-й день после отела, продемонстрировали улучшение обучения и памяти в тесте с радиальным лабиринтом с 8 рукавами по сравнению с поросятами, которых кормили смесью без добавок [22]. Кроме того, прием LF был связан с дифференциальной экспрессией 10 генов, участвующих в сигнальном пути мозгового нейротрофинового фактора (BDNF) в гиппокампе, и повышал экспрессию полисиаловой кислоты, маркера нейропластичности, клеточной миграции и дифференцировки клеток-предшественников. а также рост и нацеливание на аксоны, а также повышенное фосфорилирование белка, связывающего циклический аденозинмонофосфатный элемент, CREB, нижестоящей мишени сигнального пути BDNF и важного белка для развития нервной системы и познания [22]. В совокупности скармливание LF в концентрациях ТМ было биологически активным, и о побочных эффектах не сообщалось. В настоящее время LF добавляют в некоторые коммерческие детские смеси; тем не менее, вероятно, у LF есть неиспользованный потенциал для решения некоторых текущих иммунных, медицинских и когнитивных различий между младенцами, вскармливаемыми грудью и искусственными смесями; однако необходимы дополнительные клинические испытания.
В совокупности скармливание LF в концентрациях ТМ было биологически активным, и о побочных эффектах не сообщалось. В настоящее время LF добавляют в некоторые коммерческие детские смеси; тем не менее, вероятно, у LF есть неиспользованный потенциал для решения некоторых текущих иммунных, медицинских и когнитивных различий между младенцами, вскармливаемыми грудью и искусственными смесями; однако необходимы дополнительные клинические испытания.
Биоактивность остеопонтина
OPN представляет собой кислый, гликозилированный и высокофосфорилированный белок. Он взаимодействует с интегринами клеточной поверхности и рецептором CD44, влияя на биоминерализацию, ремоделирование тканей и иммунную регуляцию [14, 18]. Кормление макаками-резусами смеси с бычьим ОПН при средней концентрации ТМ влияло на экспрессию около 2000 кишечных генов и сдвигало общий паттерн экспрессии, чтобы он был более похож на обезьян, находящихся на грудном вскармливании [28]. OPN влиял на гены, связанные с пролиферацией, миграцией, коммуникацией и выживанием клеток, а также на гены в путях ниже по течению от рецепторов интегрина и CD44 [28]. В недавнем РКИ смеси с 65 или 130 мг бычьего OPN/л хорошо переносились и поддерживали нормальный рост. Тем не менее, у младенцев, потребляющих бычий ОПН, частота лихорадки была ниже, чем у детей со стандартной смесью, и такая же, как и у контрольной группы на грудном вскармливании [29].]. У обоих детей, получавших OPN, были более низкие уровни TNF-α, более высокие уровни интерлейкина-2 и более высокие пропорции CD3+CD45+ T-клеток по сравнению с группой, получавшей стандартную смесь [29, 30]. Эти исследования показывают, что пероральный ОПН благотворно влияет на кишечное и иммунное развитие новорожденных.
В недавнем РКИ смеси с 65 или 130 мг бычьего OPN/л хорошо переносились и поддерживали нормальный рост. Тем не менее, у младенцев, потребляющих бычий ОПН, частота лихорадки была ниже, чем у детей со стандартной смесью, и такая же, как и у контрольной группы на грудном вскармливании [29].]. У обоих детей, получавших OPN, были более низкие уровни TNF-α, более высокие уровни интерлейкина-2 и более высокие пропорции CD3+CD45+ T-клеток по сравнению с группой, получавшей стандартную смесь [29, 30]. Эти исследования показывают, что пероральный ОПН благотворно влияет на кишечное и иммунное развитие новорожденных.
Биоактивность MFGM
MFGM представляет собой тройную мембранную систему, инкапсулирующую молочный жир [31]. Он содержит холестерин, глицерол-фосфолипиды, сфинголипиды и белки, в том числе муцин-1, бутирофилин, CD36, адипофилин и лактадгерин, которые способствуют противовирусной и антибактериальной активности MGFM [31]. Действительно, обсервационное исследование младенцев в течение первых 6 мес жизни показало, что ротавирусная инфекция отрицательно связана с количеством потребляемого ТМ лактадгерина, в то время как поступление муцина и секреторного IgA с молоком не связано [32]. В недавнем РКИ была проверена безопасность и эффективность MFGM у доношенных детей, рандомизированных в возрасте до 2 месяцев для получения смеси с добавлением богатого белком препарата MFGM (4% от общего белка) или стандартной смеси [обзор в 31]. Смесями кормили до 6-месячного возраста, младенцев наблюдали до 12-месячного возраста, и их сравнивали с контрольной группой на грудном вскармливании. MFGM уменьшал диарею, средний отит, лихорадку и использование жаропонижающих [рассмотрено в 31]. Интересно, Moraxella ca tarrhalis, микроб, обычно обнаруживаемый в среднем ухе при среднем отите, был менее распространен в слюне младенцев, которых кормили смесями с MFGM, обеспечивая потенциальный механизм действия [32]. Кроме того, группа, получавшая MFGM (105,8 ± 9,2), имела значительно более высокие средние (± стандартное отклонение) баллы в когнитивной области шкалы развития младенцев и малышей Бейли по сравнению со стандартной группой (101,8 ± 8,0) [рассмотрено в 31]. Примечательно, что дети, получавшие MFGM на искусственном вскармливании, достигли когнитивных показателей, не отличающихся от детей на грудном вскармливании (106,4 ± 9).
В недавнем РКИ была проверена безопасность и эффективность MFGM у доношенных детей, рандомизированных в возрасте до 2 месяцев для получения смеси с добавлением богатого белком препарата MFGM (4% от общего белка) или стандартной смеси [обзор в 31]. Смесями кормили до 6-месячного возраста, младенцев наблюдали до 12-месячного возраста, и их сравнивали с контрольной группой на грудном вскармливании. MFGM уменьшал диарею, средний отит, лихорадку и использование жаропонижающих [рассмотрено в 31]. Интересно, Moraxella ca tarrhalis, микроб, обычно обнаруживаемый в среднем ухе при среднем отите, был менее распространен в слюне младенцев, которых кормили смесями с MFGM, обеспечивая потенциальный механизм действия [32]. Кроме того, группа, получавшая MFGM (105,8 ± 9,2), имела значительно более высокие средние (± стандартное отклонение) баллы в когнитивной области шкалы развития младенцев и малышей Бейли по сравнению со стандартной группой (101,8 ± 8,0) [рассмотрено в 31]. Примечательно, что дети, получавшие MFGM на искусственном вскармливании, достигли когнитивных показателей, не отличающихся от детей на грудном вскармливании (106,4 ± 9).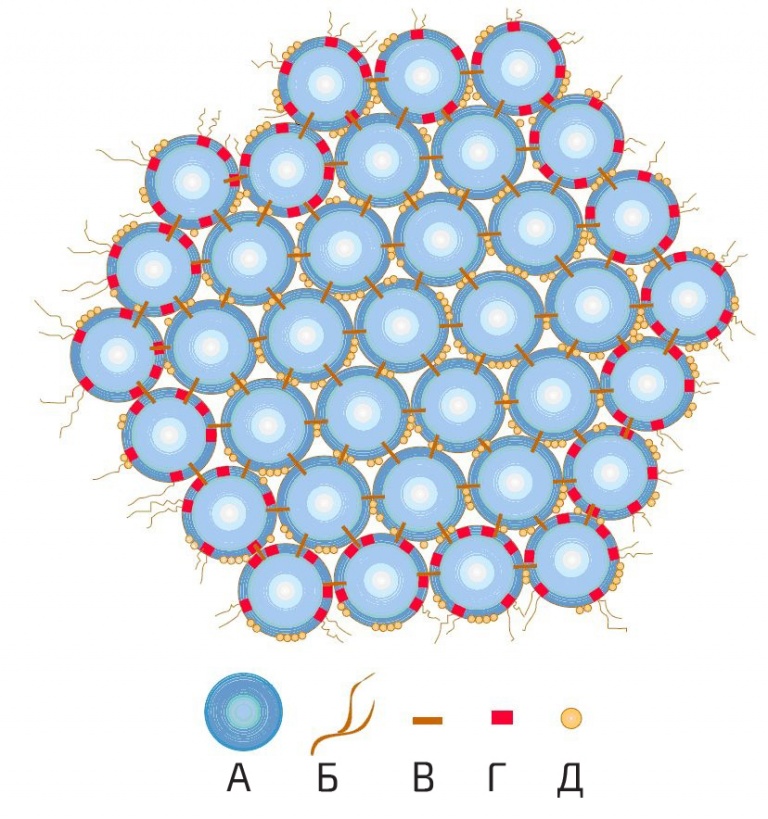 .5). В совокупности эти исследования подтверждают многофункциональное действие одного ингредиента (OPN) в снижении различий в когнитивных и иммунных исходах у детей, находящихся на грудном вскармливании и на искусственном вскармливании.
.5). В совокупности эти исследования подтверждают многофункциональное действие одного ингредиента (OPN) в снижении различий в когнитивных и иммунных исходах у детей, находящихся на грудном вскармливании и на искусственном вскармливании.
Future Directions
ТМ или молочная смесь являются единственным источником питания в течение первых 6 месяцев жизни, что является критическим периодом роста и развития младенцев [1, 8]. Недавние РКИ показали, что биоактивные белки, LF, OPN и MFGM, выделенные из коровьего молока, оказывают благотворное влияние на иммунные и когнитивные исходы у здоровых доношенных детей в краткосрочной перспективе [31]. Будущие исследования должны исследовать комбинации биоактивных компонентов (эти белки ТМ и другие компоненты, такие как олигосахариды ТМ или липиды). Кроме того, потенциальные эффекты на долгосрочное программирование иммунной системы и когнитивных функций, а также результаты в отношении здоровья должны быть исследованы путем наблюдения за этими младенцами в этих исследуемых когортах в более позднем детстве.
Ссылки
- 1 Американская академия педиатрии, секция грудного вскармливания. Грудное вскармливание и использование грудного молока. Педиатрия 2012;129:e827–e841.
- 2 Баллард О., Морроу А.Л. Состав грудного молока: питательные вещества и биологически активные факторы. Pediatr Clin North Am 2013; 60: 49–74.
- 3 Hernell O: Грудное молоко в сравнении с коровьим молоком и эволюция детских смесей. Nestle Nutr Workshop Ser Pediatr Program 2011;67:17–28.
- 4 Белл К.А., Вагнер К.Л., Фельдман Х.А. и др.: Связь вскармливания младенцев с траекториями состава тела и роста. Ам Дж. Клин Нутр 2017; 106:491–498.
- 5 Бар С., Миланаик Р., Адесман А. Долгосрочные преимущества грудного вскармливания для развития нервной системы. Curr Opin Pediatr 2016; 28: 559–566.
- 6 Davis EC, Wang M, Donovan SM: Роль питания в раннем возрасте в установлении микробного состава и функции кишечника. Кишечные микробы 2017; 8: 143–171.

- 7 Мунблит Д., Тренева М., Перони Д.Г. и др.: Иммунные компоненты грудного молока связаны с ранними показателями иммунологического здоровья младенцев: проспективный анализ в трех странах. Питательные вещества 2017;9:E532.
- 8 Виктора К.Г., Бахл Р., Баррос А.Дж. и др. Грудное вскармливание в 21 веке: эпидемиология, механизмы и пожизненный эффект. Ланцет 2016; 387: 475–490.
- 9 Lönnerdal B: Биоактивные белки в грудном молоке: здоровье, питание и значение для детских смесей. Ж Педиатр 2016; 173 (дополнение): S4–S9.
- 10 Андреас Н.Дж., Кампманн Б., Меринг Ле-Доар К. Грудное молоко человека: обзор его состава и биологической активности. Early Hum Dev 2015; 91: 629–635.
- 11 Haschke F, Haiden N, Thakkar SK: Грудное молоко: питательные и биологически активные белки. Энн Нутр Метаб 2016; 69(дополнение 2): 17–26.
- 12 Лённердал Б., Эрдманн П., Таккар С.К. и др.: Продольная эволюция истинного белка, аминокислот и биологически активных белков в грудном молоке: перспектива развития.
 J Nutr Biochem 2017;41:1–11.
J Nutr Biochem 2017;41:1–11. - 13 Ляо И., Вебер Д., Сюй В. и др.: Абсолютное количественное определение казеинов грудного молока и соотношения сыворотка/казеин в течение первого года лактации. J Proteome Res 2017; 16:4113–4121.
- 14 Schack L, Lange A, Kelsen J и др.: Значительные различия в концентрации остеопонтина в грудном молоке, коровьем молоке и детских смесях. Дж. Молочная наука, 2009 г.;92:5378–5385.
- 15 Ляо И., Альварадо Р., Финни Б. и др.: Протеомная характеристика белков сыворотки грудного молока в течение двенадцатимесячного лактационного периода. J Proteome Res 2011; 10: 1746–1754.
- 16 Liao Y, Alvarado R, Phinney B, Lönnerdal B: Протеомная характеристика мембранных белков жировых шариков грудного молока в течение 12-месячного лактационного периода. J Proteome Res 2011; 10:3530–3541
- 17 Чаттертон Д.Ю., Нгуен Д.Н., Беринг С.Б. и др. Противовоспалительные механизмы биоактивных молочных белков в кишечнике новорожденных. Int J Biochem Cell B 2013; 45:1730–1747.

- 18 Demmelmair H, Prell C, Timby N, et al: Преимущества лактоферрина, остеопонтина и мембран глобул молочного жира для младенцев. Питательные вещества 2017;9:E817.
- 19 Lönnerdal B: Детская смесь и детское питание: биоактивные белки грудного молока и влияние на состав детских смесей. Ам Дж. Клин Нутр 2014; 99: 712S–717S.
- 20 Lönnerdal B: Питательная роль лактоферрина. Curr Opin Clin Nutr Metab Care 2009; 12: 293–297.
- 21 Донован С.М.: Роль лактоферрина в развитии и функционировании желудочно-кишечного тракта и иммунитета: доклиническая перспектива. J Pediatr 2016; 173S:S16–S28.
- 22 Chen Y, Zheng Z, Zhu X и др.: Лактоферрин способствует раннему развитию нервной системы и когнитивных функций у постнатальных поросят путем усиления сигнального пути BDNF и полисиалилирования. Мол Нейробиол 2015; 52: 256–269.
- 23 Karav S, Le Parc A, Leite Nobrega de Moura Bell JM и др. Олигосахариды, высвобождаемые из молочных гликопротеинов, являются селективными субстратами для роста бифидобактерий, ассоциированных с младенцами.
 Appl Environ Microbiol 2016;82:3622–3630.
Appl Environ Microbiol 2016;82:3622–3630. - 24 Очоа Т.Дж., Чеа-Ву Э., Кампос М. и др.: Влияние добавок лактоферрина на рост и распространенность Giardia колонизация у детей. Clin Infect Dis 2008; 46: 1881–1883.
- 25 Завалета Н., Фигероа Д., Ривера Дж. и др.: Эффективность раствора для пероральной регидратации на основе риса, содержащего рекомбинантный человеческий лактоферрин и лизоцим, у перуанских детей с острой диареей. J Pediatr Gastroenterol Nutr 2007; 44:258–264.
- 26 Pammi M, Abrams SA: пероральный лактоферрин для профилактики сепсиса и некротизирующего энтероколита у недоношенных детей. Cochrane Database Syst Rev 2015;2:CD007137.
- 27 Liao Y, Jiang R, Lönnerdal B: Биохимическое и молекулярное воздействие лактоферрина на рост и развитие тонкой кишки в раннем возрасте. Biochem Cell Biol 2012; 90: 476–484.
- 28 Донован С.М., Монако М.Х., Дрневич Дж. и др.: Бычий остеопонтин модифицирует кишечный транскриптом детенышей макак-резус, находящихся на искусственном вскармливании, чтобы сделать их более похожими на тех, которых кормили грудью.


 ..
.. J Pediatr 2016; 173S:S16–S28.
J Pediatr 2016; 173S:S16–S28.
 J Nutr Biochem 2017;41:1–11.
J Nutr Biochem 2017;41:1–11.
 Appl Environ Microbiol 2016;82:3622–3630.
Appl Environ Microbiol 2016;82:3622–3630.