Содержание
10.2. Молоко как коллоидная система
Молоко представляет
собой коллоидный раствор молочного
белка и коллоидного фосфата в молочной
сыворотке. Размеры коллоидных частиц
молока составляют (в нм): мицелл казеина
– от 40 до 300, β-лактоглобулина – от 25 до
50, α-лактальбумина – от 15 до 20, фосфата
кальция – от 10 до 20. Частицы сывороточных
белков молока представлены отдельными
макромолекулами, а также их димерами и
полимерами. Их макромолекулы свернуты
в компактные глобулы, имеющие отрицательный
заряд и очень прочные гидратные оболочки.
Они обладают большой устойчивостью в
молоке, не коагулируют при достижении
изоэлектрической точки. Выделить их
можно путем уменьшения растворимости
– введением в молочную сыворотку
элетролита (высаливанием) или нагреванием
молока до высокой температуры, при
которой они денатурируют, агрегируют
с казеином и частично коагулируют.
Казеин
в молоке содержится в виде мономеров
(так называемый растворимый казеин –
около 5%)) и в форме полимеров (субмицеллярный
и мицеллярный казеин – около 95%).
Коллоидный
фосфат кальция малорастворим в воде и
образует неустойчивую коллоидную
систему. Его растворимость повышается
под влиянием казеина, вместе с которым
он входит в состав мицелл.
Из
всех фаз молока коллоидная система
самая чувствительная к воздействию
различных факторов. Изменения в молоке
наиболее заметны при нарушении коллоидного
состояния, так как при этом происходит
коагуляция белков. Неустойчивое поведение
коллоидных частиц зависит от их размеров
и связанной с этим общей поверхностью.
Особый
интерес представляет структура и
величина частиц важнейшего компонента
коллоидной системы – казеина.
Хотя
окончательно вопрос структуры мицелл
казеина не решен, на базе исследований
последних лет с использованием
электронно-микроскопических и других
методов предпочтение отдается модели
субмицеллярного строения рыхлых пористых
мицелл. Согласно этому представлению
мицеллы казеина имеют почти сферическую
форму, средний диаметр около 100 нм
(колебания от 40 до 300 нм) и молекулярную
массу в среднем 6. 108.
108.
Количество мицелл казеина в молоке
намного больше, чем жировых шариков (до
15.1015
против 15.108
в 1 см3).
Мицеллы
казеина состоят из нескольких сотен
субмицелл диаметром 10-15 нм. Субмицеллы
– это агрегаты основных фракций казеина
(αS-,
β- и κ-),соединенных между собой
гидрофобными, электростатическими,
водородными связями и кальциевыми
мостиками. Полипептидные цепи фракций
казеина свертываются в субмицелле таким
образом, что большинство гидрофобных
групп составляют ее ядро, а гидрофильные
располагаются на поверхности субмицелл.
Гидрофильная часть содержит отрицательно
заряженные кислотные группы аспарагиновой
и глютаминовой кислот (СОО—)
и фосфорной кислоты (РО32-).
Гидрофильные свойства субмицелл и
мицелл усиливают ориентированные наружу
гликомакропептиды κ-казеина,
располагающегося большей частью на
поверхности субмицелл, причем субмицеллы
различаются содержанием κ-казеина.
Субмицеллы с незначительным содержанием
κ-казеина расположены внутри мицелл, а
с высоким содержанием – на поверхности.
Пептидная часть гликомакропептидов
κ-казеина содержит большое количество
оксиаминокислот (серина и треонина),
глютаминовой и аспарагиновой кислот,
а углеводная – свободные карбоксильные
группы сиаловой кислоты. Объединение
субмицелл в мицеллы происходит, по
мнению многих исследователей, с помощью
коллоидного фосфата кальция и, возможно,
за счет цитрата кальция и гидрофобных
взаимодействий. Точный состав коллоидного
фосфата кальция и механизм его
взаимодействия с казеином пока не
установлен, но выяснено, что удаление
его из молока вызывает нарушение
структуры мицелл. В соответствии с
последними представлениями о строении
мицеллы казеина поверхность ее имеет
«волосковый слой», который распространяется
в дисперсную среду на 10-15 нм и препятствует
сближению мицелл (см.рис.5.5). «Волосковый
слой» представляет собой выступающие
с поверхности мицелл гидрофильные
участки полипептидных цепей κ-казеина
– гликомакропептиды. Мицеллы имеют
Мицеллы имеют
пористую структуру, что обусловливает
проникновение внутрь мицелл, воды и
ферментов.
Диссоциация
присутствующих на поверхности мицелл
карбоксильных групп глутаминовой,
аспарагиновой и сиаловой кислот, а также
фосфатных групп сообщает мицеллам
отрицательный заряд, что обусловливает
силы электростатического отталкивания
между коллоидными частицами.
В
свежем молоке мицеллы казеина обладают
относительной устойчивостью – не
коагулируют при механических воздействиях
(очистка, сепарирование, гомогенизация)
и при нагревании молока до высоких
температур. Для снижения их устойчивости,
то есть для коагуляции, необходимо
воздействие таких факторов, как понижение
рН, повышение концентрации ионов кальция,
внесение сычужного фермента.
Факторы
устойчивости казеина представляют
большой практический интерес. В настоящее
время в литературе их рассматривают с
позиции теории ДЛФО (теории развитой
Дерягиным Б.В. , Ландау Л.Д., Фервеем Е. И
, Ландау Л.Д., Фервеем Е. И
Овербеком Дж.). Согласно теории ДЛФО
устойчивость к коагуляции коллоиддных
растворов зависит от соотношения
молекулярных сил притяжения и
электростатических сил отталкивания
между коллоидными частицами. В свежем
молоке силы электростатического
отталкивания между мицеллами казеина
преобладают над силами молекулярного
притяжения (Ван-дер-Ваальса-Лондона),
за счет чего коллоидная система молока
находится в устойчивом состоянии.
В
нативном состоянии мицеллы казеина
имеют на своей поверхности одинаковый
заряд за счет преобладания отрицательно
заряженных карбоксильных и фосфатных
групп. По закону электронейтральности
поверхностный заряд на стороне
дисперсионной среды должен быть
компенсирован равным по величине
противозарядом. Противозаряд образуют
противоположно заряженные гидратированные
ионы кальция, называемые противоионами,
и небольшое количество одинаково
заряженных анионов. Часть противоионов
размещается в форме адсорбционного
неподвижного слоя относительно
отрицательно заряженной поверхности
мицеллы, а остальные ионы вследствие
теплового движения диффузно рассеяны.
Упрощенное изображение мицеллы казеина
с двойным электрическим слоем приведено
на рисунке 10.1. Таким образом, на границе
раздела фаз образуется двойной
электрической слой за счет положительно
заряженных противоинов кальция, другие
гидратированные ионы кальция, а также
анионы, образуют диффузный двойной
электрический слой. Электростатическое
отталкивание между мицеллами казеина
наступает только в том случае, если их
диффузные двойные слои проникают друг
в друга.
Рис. 10.1. Упрощенное
изображение мицеллы казеина с двойным
электрическим слоем:
1
– отрицательно заряженная поверхность,
внутренний слой; 2 – неподвижный
адсорбционный слой ионов Са++,
наружный слой; 3 – диффузный двойной
электрический слой катионов и анионов
молока
За количественную
меру силы электростатического отталкивания
принимают электрокинетический потенциал
(дзета-потенциал), который рассчитывают
по электрофоретической подвижности
мицелл (для нативных казеиновых мицелл
равен 47,6 мВ). Потенциальная энергия
Потенциальная энергия
электростатического отталкивания тем
больше, чем меньше расстояние между
частицами и чем больше толщина двойного
электрического слоя.
Кроме сил
электростатического отталкивания между
мицеллами казеина действуют силы
молекулярного притяжения (межмолекулярного
взаимодействия) Ван-дер-Ваальса-Лондона.
Потенциальная
энергия взаимодействия между частицами
Vскладывается из энергии
электростатического отталкиванияVЭи энергии молекулярного притяженияVМмежду ними:V=VЭ+VМ.
Эта величина может иметь как отрицательное,
так и положительное значение в зависимости
от преваливания сил отталкивания
(обозначают со знаком минус) или сил
притяжения (обозначают со знаком плюс).
Таким образом, в
свежем молоке силы электростатического
отталкивания между мицеллами казеина
преобладают над силами молекулярного
притяжения и коллоидная система находится
в устойчивом коллоидном состоянии золя.
Факторами устойчивого
коллоидного состояния золя являются
наличие на поверхности мицелл
преобладающего отрицательного заряда
за счет полярных групп (фосфатных и
карбоксильных), связывания полярными
группами молекул воды и формирования
хорошо развитой гидратной оболочки,
образования относительно заряженной
поверхности мицелл двойного электрического
слоя.
1. Коллоидная система молока
311285dok
1). Характеристика дисперсной фазы.
2). Структура мицелл казеина.
3). Коагуляция.
В коллоидно-дисперсном состоянии в
молоке находятся сывороточные белки,
казеин, большая часть фосфатов кальция.
Это самая чувствительная фаза.
Растворы белков относят к истинным
растворам, их считают однофазными
гомогенными системами. Однако, свертывание
макромолекул глобулярных белков в
водном растворе в компактные глобулы
можно считать частным случаем перехода
гомогенного истинного раствора в
двухфазный коллоидный раствор. Поэтому
Поэтому
частицы белков молока можно рассматривать
как коллоидные частицы, а их устойчивые
обратимые водные растворы — как
гидрофильные коллоидные растворы.
По свойствам и внутренней структуре
коллоидные системы делят на необратимые
(лиофобные) и обратимые (лиофильные).
Лиофобные (или гидрофобные, если
дисперсионной средой является вода)
коллоидные системы не обладают
агрегативной и термодинамической
устойчивостью, их частицы не связывают
воду, стабилизируются за счет возникновения
двойного электрического слоя на границе
раздела фаз. Системы теряют свою
устойчивость при добавлении малых
количеств электролита.
Лиофильные (или гидрофильные)
коллоидные системы обладают агрегативной
и термодинамической активностью, их
дисперсная фаза связывает значительные
количества воды и образует вокруг частиц
развитую сольватную (гидратную) оболочку,
от нее и заряда на поверхности частиц
зависит стабильность системы. Гидрофильные
Гидрофильные
коллоидные системы коагулируют при
добавлении большого количества
электролита. Размеры коллоидных частиц
молока составляют в(нм):b-лактоглобулина
25-50;a- лактоальбумина
—15-20; мицелл казеина — 40-300; фосфата
кальция — 10-20. Частицы сывороточных
белков молока представлены отдельными
макромолекулами, а также их димерами и
полимерами.
Макромолекулы белков свернуты в
компактные глобулы, имеющие отрицательный
заряд и очень прочные гидратные оболочки.
Они обладают большой устойчивостью в
молоке, не коагулируют при достижении
изоэлектрической точки, хотя при
понижении РН образует ассоциаты из
нескольких мономеров. Выделить белки
можно путем уменьшения их растворимости
— введением в молочную сыворотку
большего количества электролита, т. е.
высаливанием. Высаливание сульфатом
аммония и магния лежит в основе
фракционирования сывороточных белков
молока.
При нагревании молока до высоких
температур сывороточные белки
денатурируют, затем агрегируют и частично
коагулируют.
Казеин в молоке содержится в виде
мономеров (так называемый растворимый
казеин) и в форме полимеров (субмицеллерный
и мицеллерный казеин). Мицеллы казеина
обладают свойствами гидрофильного
золя, который при определенных условиях
может перейти в гель. Только под действием
сычужного фермента золь казеина переходит
в гель необратимо, т. е. казеин проявляет
свойства, присущие гидрофобным коллоидам.
Коллоидный фосфат кальция малорастворим
в воде и в молоке образует типичную
неустойчивую коллоидную систему с
гидрофобной дисперсной фазой. Его
растворимость повышается под влиянием
казеина, вместе с которым он входит в
состав мицелл. Таким образом, мицеллы
казеина представляют собой коллоидную
фазу смешанного состава, обладающую
свойствами гидрофильного и гидрофобного
золя. Нахождение казеина и фосфата
кальция в молоке в виде сложных мицелл
имеет большое значение для новорожденного.
Так, под действием химозина в его желудке
мицеллерный белок легко образует
сгусток, который подвергается дальнейшему
воздействию пепсина. Кроме того, в
Кроме того, в
составе растворимых мицелл казеина
транспортируются очень важные для
молодого организма соли кальция.
Структура мицелл казеина.Известно
несколько моделей структур казеина.
Сейчас получила свое признание модель
пористой структуры мицелл. Мицеллы
казеина имеют почти сферическую форму,
средний диаметр от 70 до 100 нм с колебаниями
от 40 до 300 нм, молекулярная масса 6·108(с колебаниями от 26·107до 5·109).
Мицеллы казеина состоят из нескольких
сотен субмицелл диаметром 10-15 нм и
молекулярной массой 250.000-300.000. В состав
субмицелл и мицелл не входит -казеин,
он находится в свободном состоянии.
Субмицеллы представляют собой агрегат
из 10-12 субединиц — основных фракций
казеина ( ), соединенных между собой
гидрофобными, электростатическими и
водородными связями и кальциевыми
мостиками. Соотношения между фракциями
( ) могут быть различными (3:2:1; 2:2:1), и
т. д., но с уменьшением размера субмицелл
и мицелл увеличивается относительное
содержание в них казеина.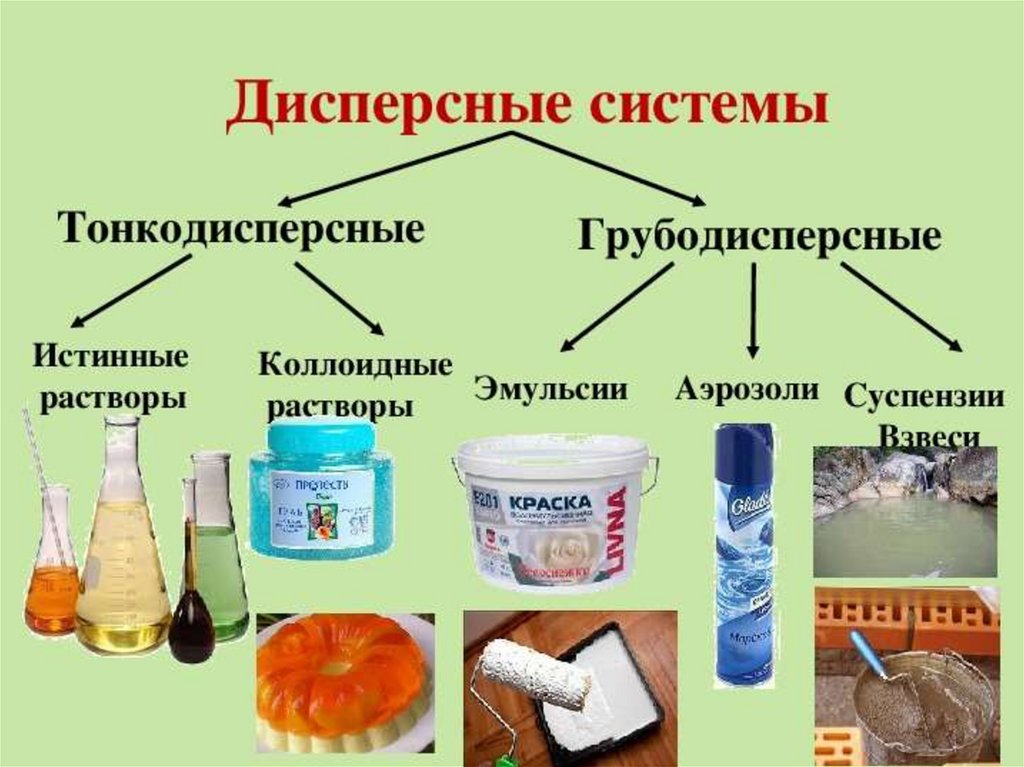 Полипентидные
Полипентидные
цепи фракций казеина свертываются в
субмицелле таким образом, что большинство
гидрофобных групп составляют основное
ядро, а гидрофильные располагаются на
поверхности субмицелл. Гидрофильная
часть (оболочка) содержит отрицательно
заряженные кислотные группы глютаминовой,
аспарагиновой и фосфорной кислот.
Усиливают гидрофильные свойства
субмицелл и мицелл, ориентированные
наружу гликомакропептиды -казеина,
которые располагаются на поверхности
субмицелл. Известно, что пептитдная
часть гликомакропептидов содержит
большое количество оксиаминокислот
(серина и треонина), глютаминовой и
аспарагиновой кислот, а углеводная —
свободные карбоксильные группы сиаловой
кислоты.
Соединения субмицелл в устойчивые
мицеллы происходит с помощью коллоидного
фосфата кальция, и возможно за счет
цитрата кальция и гидрофобных
взаимодействий. Схематично это
представлено:
Точный состав коллоидного фосфата
кальция и механизм его взаимодействия
с казеином до конца не изучен, но выяснено,
что удаление его из молока вызывает
нарушение структуру мицеллы, что
сопровождается увеличением в молоке
свободных — -казеинов, которые
чувствительны к ионам кальция.
Пористая структура мицелл позволяет
проникать внутрь их Н2О, ферментам.
Мицеллерный казеин, сильно гидратирован
— содержит 2-3,7 г и более воды на 1 г белка,
и поэтому вода не только окружает мицеллу
казеина в виде гидратной оболочки, но
и заполняет большую часть ее объема, т.
е. иммобилизуется мицеллой.
В свежем молоке мицеллы казеина устойчивы,
не коагулируют при механической обработке
(очистке, сепарировании, гомогенизации),
и нагревании молока до высоких температур.
Снижение их устойчивости и коагуляции
наблюдается лишь при понижении РН
молока, повышении концентрации ионов
кальция, внесении сычужного фермента.
А устойчивость и коагуляция коллоидных
растворов зависит от соотношения
молекулярных сил, притяжения и
электростатических сил отталкивает
между коллоидными частицами. В свежем
молоке последние силы превалируют над
силами молекул притяжения, и коллоидная
система находится в устойчивом состоянии.
И для того, чтобы вызвать соединение и
коагуляцию мицелл казеина, необходимо
снизить отрицательный заряд, т.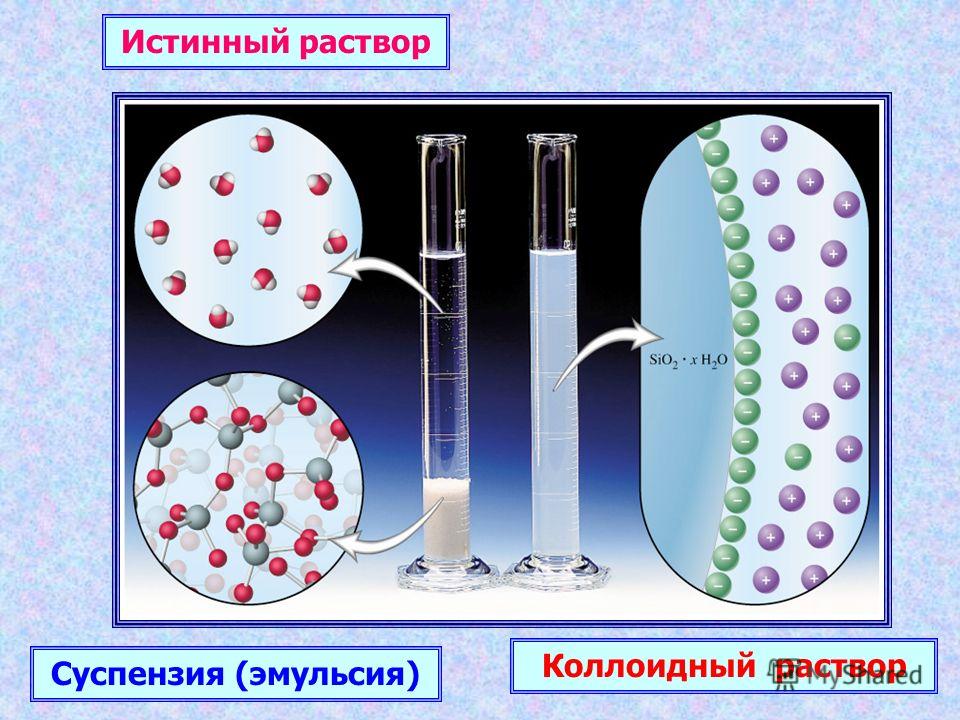 е.
е.
перевести мицеллы в изоэлектрическое
состояние, или близкое к нему, и разрушить
гидратные оболочки.
В практике коагуляцию казеина осуществляют
снижая РН молока и добавляя кислоты
(кислотная коагуляция), внося хлорид
кальция (термокальциевая коагуляция),
сычужный фермент (сычужная коагуляция).
Коагуляция— это хлопьеобразование,
оно происходит в результате дестабилизации
коллоидных частиц в изоэлектрической
точке, когда снижается количество
поверхностных зарядов и снижается
потенциал отталкивания, и гидратная
оболочка ослабевает.
Кислотная коагуляция— образуется
при осаждении белков молока молочной
кислотой или другими органическими и
неорганическими кислотами. Кислота
снижает отрицательный заряд казеиновых
мицелл, т. к. Н-ионы подавляют диссоциацию
карбоксильных групп казеина, и
гидроксильных групп. Н3РО4и при этом группы СОО — переходят в
СООН, а РО3-2в РО3Н2,
в результате достигается равенство
положительных и отрицательных зарядов
при РН 4. 6-4.7. При кислотной коагуляции
6-4.7. При кислотной коагуляции
помимо снижения отрицательных зарядов
казеина нарушает структуру ККФК, от
него отщипляются фосфаты кальция и
структурообразующий кальций, и их
переход в раствор дополнительно
стабилизирует казеиновые мицеллы.
[ККФК]+ С3О6О3 ®казеино+ Са3(РО4)2+ (С3Н5О3)2Са.
Структурообразующий кальций:
R- СН2— О
казеин
Состав коллоидного фосфата кальция,
присутствующий в частицах казеина и
характер его связи до сих пор неизвестны.
Это могут быть гидрофосфат или фосфат
кальция, их смесь, а также кальций
фосфатцитратный комплекс и др. Фосфор
коллоидного фосфата кальция в отличие
от фосфора органического, входящего в
состав казеина, называют неорганическим.
Фосфат кальция, по-видимому, может
взаимодействовать с серинофосфатными
группами казеина соединяя его молекулы
между собой наподобие кальциевых
мостиков:
Добавление кислоты снижает РН, тем самым
разрушается коллоидная система — такое
явление может носить желательное, также
нежелательное явление: при производстве
кислотного творога и технического
казеина, нежелательное явление —
самопроизвольное скисание сырого и
питьевого молока.
Сычужная коагуляция — носит необратимый
характер и включает две стадии:
ферментативную и коагуляционную. На
первой стадии под действием основного
компонента сычужного фермента —химозина
— происходит разрыв пептидной связи
фенилаланин (105) и метионин (106) в
полипептидных цепях -казеина КФК. В
результате протеолиза, молекулы
-казеина распадаются на гидрофобный
пара -казеин и гидрофильный гликомакропептид.
Схематично это выглядит так:
Гликомакролептиды имеют высокий
отрицательный заряд и обладают сильными
гидрофильными свойствами. При их
отщеплении частично разрушается
гидратная оболочка, силы электростатического
отталкивания между частицами уменьшаются
и дисперсная система теряет устойчивость.
На второй стадии дестабилизированные
мицеллы казеина (параказеина), собираются
в агрегаты и образуется сгусток, т. е.
происходит гелеобразование. Сычужная
свертываемость — желательное явление,
свертывание молока протеидами микробного
происхождения — нежелательное явление.
Кальциевая коагуляция связана со
снижением отрицательного заряда казеина
под влиянием положительно заряженных
ионов двухвалентного кальция (вводят
СаСl2).
Ее применяют в промышленности для
осаждения молочных белков из обезжиренного
молока. Коагуляцию хлоридом кальция
обычно проводят при высокой температуре
(до 85оС), поэтому она носит название
термокальциевая коагуляция.
Повышенная температура вызывает
денатурацию сывороточных белков, которые
коагулируют вместе с казеином. Белковый
продукт, полученный на основе комплексного
осаждения казеина и сывороточных белков,
называется молочным белком, или
копреципитатом. Его используют для
обогащения некоторых пищевых продуктов.
Степень использования белков при
кальциевой коагуляции при температуре
90-85оС — 96-97%; при сычужной коагуляции
— 85,6% (не осаждается казеин и лишь
небольшая часть денатурированных
сывороточных белков).
Является ли молоко коллоидом? Почему?
Молоко уже тысячи лет является одним из самых любимых молочных продуктов. По определению, он вырабатывается молочными железами млекопитающих. Более шести миллиардов человек во всем мире потребляют молоко и молочные продукты из-за их впечатляющего питательного профиля.
По определению, он вырабатывается молочными железами млекопитающих. Более шести миллиардов человек во всем мире потребляют молоко и молочные продукты из-за их впечатляющего питательного профиля.
Молоко содержит широкий спектр питательных веществ, таких как белки, жиры, витамины, минералы, полезные жиры и антиоксиданты. Эти питательные вещества могут принести пользу организму разными способами —
• Здоровье костей и мозга
• Наращивание мышечной массы и потеря веса
• Здоровье сердца и регуляция артериального давления
В этой статье мы изучим химический состав молока и наиболее популярные вопросы, связанные с ним-
• Является ли молоко коллоидное?
• Что такое коллоид и его классификация?
• Каковы свойства коллоидов?
• Является ли молоко гетерогенным или гомогенным?
• Какова стабильность коллоидной системы молока?
Молоко — это коллоид? Да, молоко коллоидное. В смеси есть крошечные шарики молочного жира. Это пример жидкости в жидком коллоиде (обычно известном как эмульсия).
Это пример жидкости в жидком коллоиде (обычно известном как эмульсия).
В общих чертах слово «чистый» означает «без примесей», однако для изучающего химию слово «чистый» означает вещество, состоящее из частиц одного типа.
Вообще, большая часть материи вокруг нас существует не в виде чистого вещества, а в виде смеси. Смесь – это комбинация более чем одного типа чистой формы материи. По характеру компонентов смеси она бывает трех видов –
• Раствор
• Коллоид
• Суспензия
Что такое коллоид?
Коллоид представляет собой смесь, которая существует в виде дисперсии микроскопических нерастворимых компонентов одного вещества в другом. Примеры – молоко, туман, дым, пыль, брызги, сыр, пена; желе и др.
Основными компонентами коллоида являются дисперсная фаза и дисперсионная среда.
Растворенный компонент коллоида, который диспергирован, известен как дисперсная фаза, тогда как компонент коллоида, в котором дисперсная фаза находится во взвешенном состоянии, называется дисперсионной средой.
Классификация коллоидов:
В зависимости от физического состояния (твердое, жидкое, газообразное) дисперсионной среды и дисперсной фазы коллоиды можно классифицировать следующим образом:
| Дисперсная фаза | Диспергирующая среда | Тип коллоида | Примеры |
|---|---|---|---|
| Твердый | Газ | Аэрозоль | Дым, автомобильный выхлоп |
| Жидкость | Газ | Аэрозоль | Туман, облака, мгла |
| Газ | Жидкость | Пена | Крем для бритья |
| Твердый | Жидкость | Сол | Молоко магнезии, грязь |
| Жидкость | Жидкость | Эмульсия | Молоко, крем для лица |
| Газ | Твердый | Пена | Пена, резина, губка, пемза |
| Твердый | Твердый | Твердый золь | Цветной драгоценный камень, молочное стекло |
| Жидкость | Твердый | Гель | Желе, сыр, масло |
По характеру взаимодействия между компонентами коллоиды можно классифицировать следующим образом:
| Гидрофильные коллоиды | Гидрофобные коллоиды |
|---|---|
| Hydro означает воду, а philic означает любовь к воде, поэтому эти коллоиды любят воду | Hydro означает воду, а phobic означает боязнь, поэтому эти коллоиды не любят воду |
| Их частицы притягиваются к молекулам воды | Их частицы отталкиваются от молекул воды |
| Обратимые золи | Необратимые золи |
| Сильное взаимодействие дисперсионной среды с дисперсной фазой | Слабое взаимодействие дисперсионной среды с дисперсной фазой |
| Поверхностное натяжение обычно ниже, чем у среды | Поверхностное натяжение такое же, как у среды |
| Вязкость выше, чем у среды | Вязкость такая же, как у среды |
| Коллоидные частицы видны под электронным микроскопом | Коллоидные частицы видны только под ультрамикроскопом |
| Примеры: агар, желатин, пектин и т. д. | Примеры: золи золота, частицы глины и т. д. |
На основании свойств частиц золя коллоиды можно классифицировать следующим образом:
| Мультимолекулярные коллоиды | Макромолекулярные коллоиды | Ассоциированные коллоиды (мицеллы) |
|---|---|---|
| Когда большое количество атомов или более мелких молекул дисперсных сред [имеющих диаметр < 1 нм] во время растворения накапливаются вместе, образуя частицы коллоидных размеров, полученные коллоидные растворы известны как полимолекулярные коллоиды. | Когда макромолекулы (имеющие высокую молекулярную массу) диспергируют в подходящей дисперсионной среде с образованием частиц коллоидных размеров, полученные коллоидные растворы называются макромолекулярными коллоидами. | Некоторые сильные электролиты при более высоких концентрациях проявляют коллоидные свойства, а молекулы дисперсной фазы образуют мицеллярные структуры. |
| Лиофобные и нестабильные по своей природе частицы связаны между собой слабыми силами Ван-дер-Валя. | Лиофильные золи обычно имеют макромолекулярную природу. | Эта конкретная концентрация, при которой коллоиды образуют мицеллы, известна как критическая мицеллярная концентрация. |
| Примеры: золь золота, золь серы | Примеры: крахмал, белки, желатин, целлюлоза, нуклеиновые кислоты, полиэтилен, полипропилен, синтетический каучук | Примеры: мыло и синтетические моющие средства |
Свойства коллоидов:
Коллоид является примером гетерогенной смеси
Вы также должны ознакомиться со статьей о том, является ли молоко гомогенной или гетерогенной смесью.
• Размер взвешенных частиц в коллоиде может составлять от 1 до 1000 нанометров (10-9 метров). Они настолько малы, что их трудно увидеть невооруженным глазом.
Они настолько малы, что их трудно увидеть невооруженным глазом.
• Коллоиды достаточно велики, чтобы рассеивать через них луч света. Итак, путь света виден в коллоиде
• Коллоиды стабильны, так как частицы не оседают, если их не трогать
• Разделение коллоидных частиц не может быть осуществлено путем фильтрации. Для этого требуется специальный метод, известный как центрифугирование
Является ли молоко коллоидом?
Молоко состоит из нескольких соединений, таких как белки и жиры. Маленькие шарики жира и белков свободно и независимо плавают в жидкости.
Они отталкиваются друг от друга и не оседают после стояния благодаря (обычно отрицательно) заряженным частицам и превращают молоко в коллоидный раствор.
Какой тип коллоида представляет собой молоко?
Молоко является примером жидкости в жидком коллоиде, известном как эмульсия. Эмульсия определяется как смесь двух или более несмешивающихся жидкостей. В молочной эмульсии молочный жир смешивают с водой.
Другой пример эмульсии включает воду + масло
Является ли молоко раствором?
| Раствор | Коллоид |
|---|---|
| Размер частиц менее 1 нм. | Размер частиц 1-1000нм. |
| Однородные по своей природе | Гетерогенны по своей природе |
| Истинные решения не показывают эффект Тиндаля | Коллоиды проявляют эффект Тиндаля в своем коллоидном растворе |
| Фильтрация используется для отделения частиц | Фильтрация не может использоваться для отделения частиц |
| Пример: раствор сахара в воде | Пример: Крахмал, растворенный в воде |
Как обсуждалось выше, молоко состоит из воды и небольших шариков жиров и белков, плавающих в смеси.
В отличие от истинных растворов, он неоднороден по своей природе. На самом деле частицы достаточно велики, чтобы рассеивать через них луч света и проявлять эффект Тиндаля. Это соответствует свойствам коллоида.
Это соответствует свойствам коллоида.
Следовательно, молоко не является решением.
Является ли молоко суспензией?
| Подвеска | Коллоид |
|---|---|
| Размер частиц более 1000 нм. | Размер частиц 1-1000 нм. |
| Частицы видны невооруженным глазом. | Частицы достаточно малы, чтобы их можно было увидеть невооруженным глазом по отдельности. |
| Частицы нестабильны, так как через некоторое время оседают. | Частицы стабильны, так как не оседают через некоторое время. |
| Пример: Смесь мела и воды | Пример: молоко и кровь |
Если вы исследуете каплю молока под микроскопом, можно увидеть крошечные шарики белков и жиров, взвешенных в жидкости.
Кроме того, в отличие от суспензии, они не оседают после стояния, что свидетельствует о том, что молоко является коллоидом.
Стабильность коллоидной системы в молоке
Стабильность коллоидной системы – это способность частиц оставаться взвешенными в растворе при равновесии. Динамика явления агрегации и седиментации нарушают стабильность коллоида.
Динамика явления агрегации и седиментации нарушают стабильность коллоида.
Молоко представляет собой коллоидный раствор, в котором мельчайшие шарики жира отталкиваются друг от друга благодаря наличию одинаковых и эквивалентных отрицательных зарядов. Они не объединяются вместе, образуя более крупные частицы. Они просто свободно плавают в жидкости, не образуя комков.
Однако, когда рН молока изменяется или становится кислым (например, при добавлении сока лайма в кипящую воду), молекулы молочного белка (казеина и др.) начинают притягиваться друг к другу. Это приводит к образованию «сгустков», комков или длинных цепочек.
Далее эти длинные цепи белковых молекул отделяются от молекул воды и образуют осадок, известный как «чхена» или «панир».
Обязательно к прочтению: pH молока – кислотный или щелочной
Заключение
Смесь состоит из двух или более веществ, смешанных в любой пропорции. Он может быть трех видов: истинный раствор, суспензия и коллоиды.
Он может быть трех видов: истинный раствор, суспензия и коллоиды.
Истинный раствор представляет собой гомогенную смесь. Он состоит из двух компонентов – растворенного и растворяющего. Размер частиц раствора составляет ˂ 1 нм, поэтому они не видны невооруженным глазом и не проявляют эффекта Тиндаля. Они стабильны по своей природе.
Суспензии представляют собой гетерогенные смеси, в которых одно вещество растворимо в другом. Размер частиц суспензии очень велик, поэтому их легко увидеть невооруженным глазом. Они нестабильны по своей природе, поэтому они оседают, если их не трогать.
Коллоиды представляют собой гетерогенные смеси. Размер частиц достаточно мал, чтобы их можно было увидеть невооруженным глазом; однако они достаточно велики, чтобы показать эффект Тиндаля. В коллоиде есть два компонента – дисперсная фаза и дисперсионная среда.
Молоко является примером коллоидного раствора. Он имеет плавающие мелкие частицы жира и белковые глобулы, которые проявляют эффект Тиндаля, а также не оседают через некоторое время. Поэтому, когда вы ставите молоко на ночь в холодильник, его состав остается прежним. Никакие жирные капли не оседают. Они остаются там, где они есть.
Поэтому, когда вы ставите молоко на ночь в холодильник, его состав остается прежним. Никакие жирные капли не оседают. Они остаются там, где они есть.
[Решено] Что является примером коллоида?
Этот вопрос ранее задавался в
MPPEB, группа 2, подгруппа 4, официальный документ 1 (состоялся: 30 января 2021 г., смена 1)
Посмотреть все MP VYAPAM GROUP 2 Документы>
- водный раствор NAPL
- молоко
- Water
- Iron
Вариант 2: Milk
Haryana Pathari/GRAM4: MILK 9000 2
HARYANA.
23,3 тыс. пользователей
90 вопросов
90 баллов
90 минут
Правильный ответ Молоко .
Ключевые точки
- Молоко является примером коллоидного раствора , в котором дисперсной фазой является жир, а дисперсионной средой является вода.
 Значит, вариант 2 правильный.
Значит, вариант 2 правильный. - В коллоидном растворе частицы достаточно велики, чтобы рассеивать луч света и проявлять эффект Тиндаля.
- Размер частиц в коллоиде больше, чем у истинного раствора, но меньше, чем у суспензии. Если рассмотреть каплю молока под микроскопом, то можно увидеть мелкие частицы жира, плавающие в жидкости. поэтому молоко называют коллоидным раствором.
- Другими примерами коллоидов являются цветные драгоценные камни, желатин, чернила и т. д.
Дополнительная информация
- Важно Типы коллоидных растворов.
Дисперсная фаза | Дисперсионная среда | Тип раствора | Примеры |
Твердое или жидкое | Газ | Аэрозоль | Дым |
Газ | Жидкость | Пена | Крем для бритья |
Жидкость | Жидкость | Эмульсия | Молоко, крем для лица |
Скачать решение PDF
Поделиться в WhatsApp
Последние обновления Haryana Patwari
Последнее обновление: 21 сентября 2022 г.


 Значит, вариант 2 правильный.
Значит, вариант 2 правильный.